OXIRREDUÇÃO
Numa reação de oxirredução sempre há perda e ganho simultâneos de elétrons, pois os que são perdidos por um átomo, íon ou molécula são imediatamente recebidos por outros.
A perda de elétrons é chamada de oxidação.
O ganho de elétrons é chamado de redução.
Este processo de perda e ganho de elétrons alteram os números de oxidação dos elementos da seguinte forma:
(Nox) se reduz ( pois o elemento ganha elétrons).
Redutores e oxidantes
O agente redutor é que provoca a redução, perdendo elétrons.
Entretanto, perder elétrons significa se oxidar, podemos dizer então que:
O agente redutor se oxida ( ou sofre oxidação)
O agente oxidante provoca a oxidação, recebendo elétrons.
O agente oxidante se reduz ( ou sofre redução)
Redução: ganho de elétrons ( diminuição de Nox) |
Oxidação: perda de elétrons ( aumento de Nox) |
Redutor: fornece elétrons e se oxida (Nox aumenta) |
Oxidante: recebe elétrons e se reduz (Nox diminui) |
O redutor reduz o oxidante |
O oxidante oxida o redutor |
Nem todas as reações são de oxirredução.
Nas reações de oxirredução sempre ocorre alguma mudança do número de oxidação de pelo menos dois elementos ( o oxidante e o redutor).
Exemplo:
H2O2 H2O + ½ O2 (decomposição da água oxigenada)
Nas reações sem oxirredução , nenhum elemento sofre mudança no número de oxidação (Nox).
Exemplo:
SO2 + H2O
Regras práticas para determinar o número de oxidação |
1. Os átomos dos elementos e das substâncias simples tem Nox = 0. Exemplos : Al , O2 |
2.Nos compostos contendo hidrogênio, o átomo desse elemento tem geralmente Nox = + |
3.O número de oxidação do oxigênio em seus compostos é , geralmente, igual a –2. Porém , se esse elemento estiver ligado ao flúor, o único átomo mais eletronegativo que o oxigênio , poderão acontecer os seguintes casos: em OF2 , o oxigênio terá Nox = +2 e em O2F2, o oxigênio terá Nox = +1, na água oxigenada H2O2 o Nox é igual a = -1 |
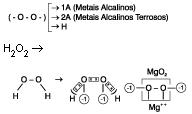
4.Os metais alcalinos ( família IA) e a prata Ag tem sempre Nox = +1 |
5. Os metais alcalinos terrosos ( família IIA) e o zinco Zn tem sempre Nox = +2 |
6.Os halogênios ( família Nox = -1 . |
Abaixo alguns exercícios resolvidos sobre cálculo de número de oxidação em substâncias
Exemplos de oxidantes e redutores.
Processo de obtenção de água de cloro
O cloro reage com a água formando HCl e HClO, a solução resultante recebe o nome de água de cloro:
Cl2 (g) + H2O (l) =HCl (aq) + HClO (q)
O HClO é poderoso oxidante
Com soluções de hidróxidos , em vez de ácidos, formam-se os sais correspondentes. Vejamos a reação com NaOH (aq)
Cl2 + 2 NaOH (aq)=NaCl (aq) + NaClO (aq) + H2O (l)
Ou por etapas:
Cl2 + H2O =HCl + HClO
HCl + NaOH =NaCl + H2
HClO + NaOH=NaClO + H2O
Cl2(g) + 2 NaOH (aq) = NaCl (aq) + NaClO (aq) + H2O(l)
Esta é uma reação de auto – redução , pois parte do cloro se oxida e parte se reduz. O cloro (Cl2) e o hipoclorito (ClO -) por serem agentes oxidantes, são utilizados como alvejantes e desinfetantes.
O cloro é utilizado como alvejante na fabricação do papel, raiom, algodão, linho e como desinfetante na obtenção da água potável e nas piscinas. A ação batericida do cloro é devida ao ácido hipocloroso que se forma por reação com a água e que tem uma ação fatal sobre as bactérias.
Água oxigenada
a água oxigenada pode atuar como oxidante ou como redutora, exemplos:
como oxidante
H2O2 + SO3 2- = H2O + SO4 2 -
Aqui ela oxida o SO4 2 - a SO32-
como redutora
H2O2 + MnO4 - + H+ = Mn 2+ + O2 + H2O
Aqui ela reduz o MnO4- a Mn 2+
Água oxigenada
É um composto pouco estável, decompondo –se facilmente em água e oxigênio
2H 2O2 = H2O + O2
A decomposição é facilitada pela ação da luz ( por isso a água oxigenada é guardada em frascos escuros) .
Emprega-se água oxigenada com bactericida no tratamento de feridas, pois o oxigênio nascente liberado destrói as bactérias:
H2O2 = H2O + [O]
a água oxigenada encontrada no comércio constitui uma solução de água oxigenada , ou seja, H2O2, dissolvida em água.
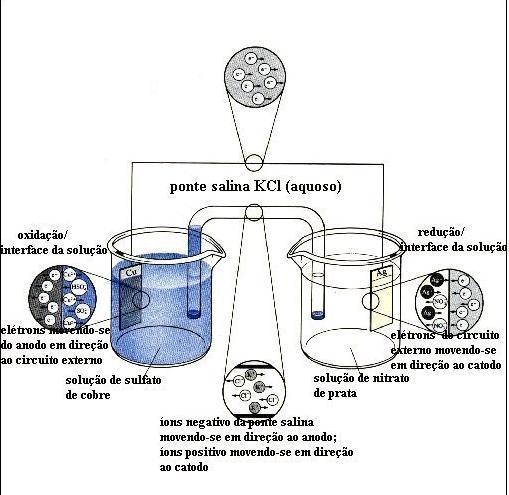
As reações de deslocamento são reações de oxidorredução
Veja o exemplo abaixo:
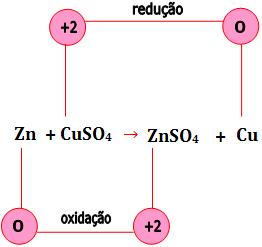
Os elétrons do Zn são transferidos para o Cu+2, conseqüentemente o número de de oxidação varia.
Equação iônica
Seja a reação do zinco com sulfato de cobre em solução aquosa:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Os sais encontram-se dissociados em solução aquosa:

Veja que os íons sulfato não participam da reação. Ocorre uma transferência de elétrons do metal zinco para o íon Cu2+.
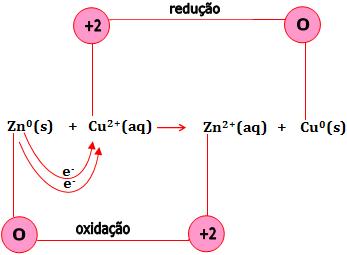
Semi-reação de oxidação e redução
Seja uma reação que ocorre quando submergimos uma barra de zinco numa solução contida de íons Cu+2, obtida através da dissolução de sulfato de cobre em água.
Normalmente, a reação que ocorrerá pode ser representada pela equação abaixo:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Os sais estão dissociados:
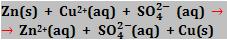
Veja que os íons não participam de fato da reação:
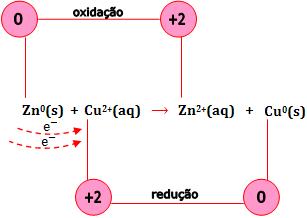
A reação é formada a partir de uma conversão de elétrons do átomo de zinco para o íon Cu2+.
Na reação citada, cobre metálico é depositado na superfície do zinco e a cor azul do íon Cu2+ oculta-se quando é substituído pelo íons Zn+2 incolor.
A reação pode ser dividida em duas partes:

Ao somar as duas semi-reações, obtemos a reação global. Veja que o número de elétrons cedidos é igual ao número de elétrons recebidos.
Fila de reatividade química dos ametais
Quanto maior for a eletronegatividade, maior será a reatividade do não-metal.

Os ametais também sofrem reações espontâneas e reações não-espontâneas.
Exemplo:
Flúor (F2) desloca o iodo dos iodetos (I-).
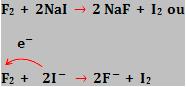
Assim como o iodo (I2) não desloca o cloro dos cloretos (Cl-).

O nox dos calcogênios (O, S, Se, Te, Po), quando estão na extremidade mais eletronegativa (direta), vale –2. Quando estão em outra posição, o nox é variável.
Ex:
Obs.: na pirita (FeS2), embora o enxofre esteja na extremidade mais eletronegativa, seu nox não é –2 e sim –1.
Óxido-redução
Significa transferência de elétrons e conseqüen-temente variação do n.° de oxidação (nox).
Conceitos
1. Oxidação: oxidar significa perder elétrons e conseqüentemente aumentar o nox.
2. Redução: reduzir significa ganhar elétrons e conseqüentemente diminuir o nox.
3. Agente oxidante: é a espécie química que contém o elemento que sofre redução. O oxidante provoca a oxidação de outra espécie química na reação.
4. Agente redutor: é a espécie química que contém o elemento que sofre oxidação. O redutor provoca a redução de outra espécie química na reação.
Observações:
1) Quem oxida ou quem reduz é sempre elemento químico.
2) O agente oxidante e o agente redutor sempre estão do lado dos reagentes da reação.
5. Número de oxidação: é a carga que o elemento tem ou adquire durante a reação.
Tipos de nox:
a) Nox real: é a carga que o elemento já possui. É característica de compostos iônicos.
b) Nox aparente: é a carga que o elemento adquire quando suas ligações forem rompidas durante a reação. É característica de compostos covalentes.
Obs.: Nox na ligação covalente dativa ou coordenada.
Situação “A”
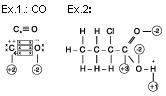
Situação “B”
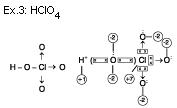
Regras para o cálculo de nox.
1.a O nox de uma substância simples ou de um elemento químico vale sempre zero.
Balanceamento de equações pelo método redox:
Princípio Básico.
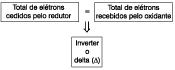
1.° Calcular o nox de cada elemento na equação, ultilizando as regras para o cálculo do nox.
2.° Verificar quem varia o nox de um lado para outro na reação e traçar os ramais oxi-red.
3.° Montar dois quadros. Um para oxidação e outro para redução. É necessário que a substância candidata a ir para um dos quadros não tenha nox repetido na equação. Caso ambas as substâncias não tenham nox repetido na equação, vai para o quadro, na seguinte sequência:
1) A substância de maior atomicidade (é o número de átomos do elemento que constitui a substância).
2) A substância de maior número de elementos diferentes.
4.° Calcular, inverter e se possível simplificar o delta (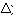 ).
).
Obs.: Cálculo do delta (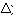 ).
).
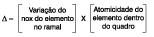
5.° Prosseguir o balanceamento por tentativa sendo que o último elemento a ser balanceado é o oxigênio, e o penúltimo o hidrogênio.
Coeficiente na reação:
2KMnO4 + 5H2C2O4 + H2SO4 K2SO4 + MnSo4 + CO2 + H2O
Prosseguir por tentativa:
2KMnO4 + 5H2C2O4 + 3H2SO4 1K2SO4 + 2MnSO4 + 10CO2 + 8H2O
A quantidade de oxigênio é o tira prova.
Obs. 1: Sofreu redução o elemento quimico manganês.
Obs. 2: Quem sofreu oxidação foi o elemento quimico carbono.
Obs. 3: O agente oxidante foi a espécie quimica KMnO4.
Obs. 4: O agente redutor foi a espécie quimica H2C2O4.
Casos particulares de balanceamento por oxi-redução.
1) A substância ou o elemento que sofre auto oxi-redução não vai para o quadro.
2) A substância ou o elemento que sofre auto oxi-redução pode funcionar tanto como oxidante quanto como redutor, desde que esteja no lado dos reagentes.
Aplicação
Faça o balanceamento da reação abaixo:
Cl2+ NaOH → NaCl+NaClO2+H2O
Solução:
1.º passo: Calcular o Nox de cada elemento.
2.º passo: Traçar o ramal da oxidação e da redução e calcular a quantidade de elétrons perdidos e recebidos.
3.º passo: Montar os quadros.
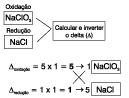
Prosseguir o balanceamento por tentativa:
3Cl2 + 6NaOH 5NaCl + 1NaClO3 + 3H2O
Observações:
1) A quantidade de oxigênio antes depois da reação, tem de ser a mesma.
2) Sofreu redução o elemento químico Cloro.
3) Sofreu oxidação o elemento químico Cloro.
4) O agente oxidante e agente redutor é a mesma espécie quimica Cl2.
O nox de íon é igual à sua própria carga.
Ex.:Cl- ; H+ ; Al+++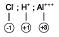
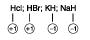
3.a O nox do hidrogênio vale geralmente +1, exceto nos hidretos metálicos (hidrogênio ligado a metal) que vale –1.
Ex. :Hcl ; HBr ; KH ; NaH
4.a O nox do oxigênio vale geralmente –2;
Ex.:
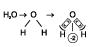
Exceções:
a) Nos peróxidos vale -1 (O2-2)
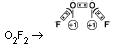
b) Nos superóxidos vale –1/2 (O4-2)
c) Nos flutores vale +2
5.a A somatória das cargas de uma molécula vale sempre zero.
6.a A somatória das cargas de um agrupamento iônico (reunião de átomos em desequilíbrio elétrico) é igual à carga do agrupamento.
7.a O nox dos halogênios, quando estão na extremidade mais eletronegativa (direta), vale –1. Quando estão em outra posição, o nox é variável.
Ex:
· Nox mínimo: é a carga que o elemento necessita para atingir o octeto.
· Nox máximo: é a carga que o elemento adquire quando perde todos os elétrons da última camada. O nox máximo coincide com o n.° do grupo.
Obs.: 4A, 5A, 6A, 7A NOX MÍNIMO
NOX MÁXIMO
Veja o exemplo abaixo:

Os elétrons do Zn são transferidos para o Cu+2, conseqüentemente o número de de oxidação varia.
Equação iônica
Seja a reação do zinco com sulfato de cobre em solução aquosa:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Os sais encontram-se dissociados em solução aquosa:
Veja que os íons sulfato não participam da reação. Ocorre uma transferência de elétrons do metal zinco para o íon Cu2+.

Semi-reação de oxidação e redução
Seja uma reação que ocorre quando submergimos uma barra de zinco numa solução contida de íons Cu+2, obtida através da dissolução de sulfato de cobre em água.
Normalmente, a reação que ocorrerá pode ser representada pela equação abaixo:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Os sais estão dissociados:
Veja que os íons não participam de fato da reação:

A reação é formada a partir de uma conversão de elétrons do átomo de zinco para o íon Cu2+.
Na reação citada, cobre metálico é depositado na superfície do zinco e a cor azul do íon Cu2+ oculta-se quando é substituído pelo íons Zn+2 incolor.
A reação pode ser dividida em duas partes:

Ao somar as duas semi-reações, obtemos a reação global. Veja que o número de elétrons cedidos é igual ao número de elétrons recebidos.
Fila de reatividade química dos ametais
Quanto maior for a eletronegatividade, maior será a reatividade do não-metal.

Os ametais também sofrem reações espontâneas e reações não-espontâneas.
Exemplo:
Flúor (F2) desloca o iodo dos iodetos (I-).
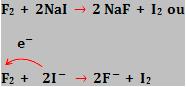
Assim como o iodo (I2) não desloca o cloro dos cloretos (Cl-).

O nox dos calcogênios (O, S, Se, Te, Po), quando estão na extremidade mais eletronegativa (direta), vale –2. Quando estão em outra posição, o nox é variável.
Ex:
Obs.: na pirita (FeS2), embora o enxofre esteja na extremidade mais eletronegativa, seu nox não é –2 e sim –1.
Óxido-redução
Significa transferência de elétrons e conseqüen-temente variação do n.° de oxidação (nox).

Conceitos
1. Oxidação: oxidar significa perder elétrons e conseqüentemente aumentar o nox.
2. Redução: reduzir significa ganhar elétrons e conseqüentemente diminuir o nox.
3. Agente oxidante: é a espécie química que contém o elemento que sofre redução. O oxidante provoca a oxidação de outra espécie química na reação.
4. Agente redutor: é a espécie química que contém o elemento que sofre oxidação. O redutor provoca a redução de outra espécie química na reação.
Observações:
1) Quem oxida ou quem reduz é sempre elemento químico.
2) O agente oxidante e o agente redutor sempre estão do lado dos reagentes da reação.
5. Número de oxidação: é a carga que o elemento tem ou adquire durante a reação.
Tipos de nox:
a) Nox real: é a carga que o elemento já possui. É característica de compostos iônicos.
b) Nox aparente: é a carga que o elemento adquire quando suas ligações forem rompidas durante a reação. É característica de compostos covalentes.
Obs.: Nox na ligação covalente dativa ou coordenada.
Situação “A”

Situação “B”

Regras para o cálculo de nox.
1.a O nox de uma substância simples ou de um elemento químico vale sempre zero.
Balanceamento de equações pelo método redox:
Princípio Básico.

1.° Calcular o nox de cada elemento na equação, ultilizando as regras para o cálculo do nox.
2.° Verificar quem varia o nox de um lado para outro na reação e traçar os ramais oxi-red.
3.° Montar dois quadros. Um para oxidação e outro para redução. É necessário que a substância candidata a ir para um dos quadros não tenha nox repetido na equação. Caso ambas as substâncias não tenham nox repetido na equação, vai para o quadro, na seguinte sequência:
1) A substância de maior atomicidade (é o número de átomos do elemento que constitui a substância).
2) A substância de maior número de elementos diferentes.
4.° Calcular, inverter e se possível simplificar o delta (
Obs.: Cálculo do delta (
5.° Prosseguir o balanceamento por tentativa sendo que o último elemento a ser balanceado é o oxigênio, e o penúltimo o hidrogênio.
Coeficiente na reação:
2KMnO4 + 5H2C2O4 + H2SO4 K2SO4 + MnSo4 + CO2 + H2O
Prosseguir por tentativa:
2KMnO4 + 5H2C2O4 + 3H2SO4 1K2SO4 + 2MnSO4 + 10CO2 + 8H2O
A quantidade de oxigênio é o tira prova.
Obs. 1: Sofreu redução o elemento quimico manganês.
Obs. 2: Quem sofreu oxidação foi o elemento quimico carbono.
Obs. 3: O agente oxidante foi a espécie quimica KMnO4.
Obs. 4: O agente redutor foi a espécie quimica H2C2O4.
Casos particulares de balanceamento por oxi-redução.
1) A substância ou o elemento que sofre auto oxi-redução não vai para o quadro.
2) A substância ou o elemento que sofre auto oxi-redução pode funcionar tanto como oxidante quanto como redutor, desde que esteja no lado dos reagentes.
Aplicação
Faça o balanceamento da reação abaixo:
Cl2+ NaOH → NaCl+NaClO2+H2O
Solução:
1.º passo: Calcular o Nox de cada elemento.
2.º passo: Traçar o ramal da oxidação e da redução e calcular a quantidade de elétrons perdidos e recebidos.
3.º passo: Montar os quadros.

Prosseguir o balanceamento por tentativa:
3Cl2 + 6NaOH 5NaCl + 1NaClO3 + 3H2O
Observações:
1) A quantidade de oxigênio antes depois da reação, tem de ser a mesma.
2) Sofreu redução o elemento químico Cloro.
3) Sofreu oxidação o elemento químico Cloro.
4) O agente oxidante e agente redutor é a mesma espécie quimica Cl2.
O nox de íon é igual à sua própria carga.
Ex.:Cl- ; H+ ; Al+++
3.a O nox do hidrogênio vale geralmente +1, exceto nos hidretos metálicos (hidrogênio ligado a metal) que vale –1.
Ex. :Hcl ; HBr ; KH ; NaH
4.a O nox do oxigênio vale geralmente –2;
Ex.:
Exceções:
a) Nos peróxidos vale -1 (O2-2)

b) Nos superóxidos vale –1/2 (O4-2)
c) Nos flutores vale +2
5.a A somatória das cargas de uma molécula vale sempre zero.
6.a A somatória das cargas de um agrupamento iônico (reunião de átomos em desequilíbrio elétrico) é igual à carga do agrupamento.
7.a O nox dos halogênios, quando estão na extremidade mais eletronegativa (direta), vale –1. Quando estão em outra posição, o nox é variável.
Ex:
· Nox mínimo: é a carga que o elemento necessita para atingir o octeto.
· Nox máximo: é a carga que o elemento adquire quando perde todos os elétrons da última camada. O nox máximo coincide com o n.° do grupo.
Obs.: 4A, 5A, 6A, 7A NOX MÍNIMO
NOX MÁXIMO
PARTE-II:
Reação de oxirredução
Reação de oxirredução ou redox - Reação com transferência de elétrons de um reagente para outro, ou reação com variação de nox de pelo menos um elemento.Oxidação - Perda de elétrons ou aumento de nox.
Redução - Ganho de elétrons ou diminuição de nox.
Agente oxidante ou substância oxidante - Substância que sofre a redução ou substância que ganha elétrons.
Agente redutor ou substância redutora - Substância que sofre a oxidação ou substância que perde elétrons.
Balanceamento de equações de oxirredução - Fundamenta-se no fato de o número de elétrons cedidos na oxidação ser igual ao número de elétrons recebidos na redução.

Nenhum comentário:
Postar um comentário