A Química está presente em nosso dia a dia, como por exemplo, nos medicamentos, nas pilhas e baterias, nos processos de corrosão etc.
A Química é dividida em:
Química orgânica – ciência que estuda as propriedades da composição e das reações químicas dos compostos organidos do carbono.
Química Inorgânica – ciência que estuda as propriedades da composição e das reações químicas dos demais compostos elementos químicos.
Físico-Química – ciência que estuda questões químicas relacionadas à Física.
Química Analítica – ciência que analisa amostras químicas para descobrir sua composição estrutural e quantidade de elementos químicos.

O composto de amônia é muito utilizado na produção de fertilizantes
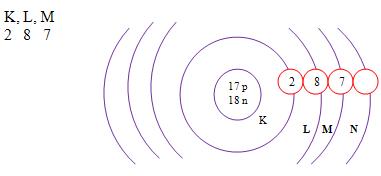
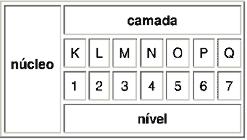
2. Conceito de átomo
Átomo é a menor parte da matéria em que ela pode ser dividida, logo podemos perceber que a matéria é composta por minúsculas partículas, que são de diferentes tamanhos e pesos. Até hoje se sabe da existência de mais de 100 tipos variados de átomos.

Átomo é a menor parte da matéria em que ela pode ser dividida, logo podemos perceber que a matéria é composta por minúsculas partículas, que são de diferentes tamanhos e pesos. Até hoje se sabe da existência de mais de 100 tipos variados de átomos.

Substâncias e Misturas
QUÍMICA
É a ciência que estuda as substâncias, determinando as suas propriedades físicas (cor, ponto de fusão, ponto de ebulição, densidade, etc.), as transformações dessas substâncias em outras, bem como a energia envolvida nesses processos.
FENÔMENOS FÍSICOS E QUÍMICOS
Um fenômeno físico ocorre sem que a substância transforme-se noutra substância; já um fenômeno químico é aquele que ocorre com a transformação de substância numa nova substância.
Portanto, num fenômeno físico, as substâncias existentes antes e depois da transformação são as mesmas. Num fenômeno químico, as substâncias existentes antes são diferentes das existentes depois da transformação.
A evaporação do álcool é um fenômeno físico: o álcool líquido passa para a forma de vapor. O azedamento do vinho é um fenômeno químico: o vinho é transformado em vinagre. O álcool existente no vinho é transformado em ácido acético, principal constituinte do vinagre.
MATÉRIA E ENERGIA
Matéria é tudo que tem massa e ocupa lugar no espaço. Exemplo: pedra, madeira, ar, água, etc. Uma porção limitada de matéria é chamada de corpo (ex.: pedaço de madeira).
Energia é a capacidade de realizar trabalho, podendo apresentar-se na forma de energia calorífica, elétrica, cinética, mecânica, luminosa, potencial, nuclear e química.
SISTEMAS
É a parte do universo físico cujas propriedades estão sob investigação científica.
Sistema aberto: pode trocar matéria ou energia com o meio ambiente.
Sistema fechado: pode trocar energia, mas não pode trocar matéria com o meio ambiente.
Sistema isolado: não pode trocar matéria nem energia com o meio ambiente.
Sistema homogêneo: apresenta aspecto visual uniforme e mesmas propriedades em toda a sua extensão. O sistema homogêneo ou é uma mistura homogênea ou é uma substância pura nu único estado físico. (Ex.: água + álcool).
Sistema heterogêneo: não apresenta as mesmas propriedades em toda a sua extensão. O sistema heterogêneo ou é uma mistura heterogênea (Ex.: água + areia) ou é uma substância pura em mudança de estado físico. (Ex.: água + gelo).
Substância Pura
É todo material com as seguintes características:
a) Unidades estruturais (moléculas, conjuntos iônicos) quimicamente iguais entre si
b) Composição fixa, do que decorrem propriedades fixas, como densidade, ponto de fusão e de ebulição, etc.
c) A temperatura mantém-se inlterada desde o início até o fim de todas as suas mudanças de estado físico (fusão, ebulição, solidificação, etc.)
d) Pode ser representada por uma fórmula porque tem composição fixa.
Classificação das substâncias
Simples: constituída por um único elemento químico.
Exs.: O2, H2, N2, P4, Fe, C.
Composta: constituída por mais de um elemento químico.
Exs.: CO2, H2O, CH4, C2H5OH, Fe2O3.
Mistura
É qualquer sistema formado de duas ou mais substâncias puras, denominadas componentes. Não apresentam ‘constantes físicas’ definidas; ponto de fusão, ebulição, densidade absoluta, mudam com a composição da mistura.
Classificação de Misturas:
Homogêneas (Soluções) Constitui uma só fase
Exs.: Água + Álcool
Ar atmosférico
Heterogêneas Constitui duas ou mais fases
Exs.: Água + Areia
Água + Óleo + Areia
Fase
É cada uma das partes homogêneas de um sistema. Cada fase é caracterizada por uma densidade diferente.
Componente
É cada substância que entra na composição do sistema.

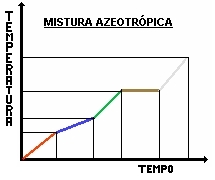
MISTURAS AZEOTRÓPICAS E EUTÉTICAS
Mistura Azeotrópica:
A temperatura mantém-se constante durante a ebulição, e a composição não muda.Ex.: 96% de álcool etílico com 4% de água (álcool 96 °GL)
Simples: constituída por um único elemento químico.
Exs.: O2, H2, N2, P4, Fe, C.
Composta: constituída por mais de um elemento químico.
Exs.: CO2, H2O, CH4, C2H5OH, Fe2O3.
Mistura
É qualquer sistema formado de duas ou mais substâncias puras, denominadas componentes. Não apresentam ‘constantes físicas’ definidas; ponto de fusão, ebulição, densidade absoluta, mudam com a composição da mistura.
Classificação de Misturas:
Homogêneas (Soluções) Constitui uma só fase
Exs.: Água + Álcool
Ar atmosférico
Heterogêneas Constitui duas ou mais fases
Exs.: Água + Areia
Água + Óleo + Areia
Fase
É cada uma das partes homogêneas de um sistema. Cada fase é caracterizada por uma densidade diferente.
Componente
É cada substância que entra na composição do sistema.

MISTURAS AZEOTRÓPICAS E EUTÉTICAS
Mistura Azeotrópica:
A temperatura mantém-se constante durante a ebulição, e a composição não muda.Ex.: 96% de álcool etílico com 4% de água (álcool 96 °GL)

4. Alotropia
Conceituação de alotropia
Alotropia é quando um mesmo elemento químico tem o poder de originar substâncias simples e diferentes, tais substâncias foram denominadas de alótropos ou formas alotrópicas, por exemplo:
Elemento: oxigênio
Formas alotrópicas: oxigênio (O2) e Ozônio (O3).
Elemento: carbono
Formas alotrópicas: grafita (Cn), diamante (Cn).
Diferenças entre alótropos
O elemento alótropo pode diferenciar-se em:
- na quantidade de átomos que uma molécula de um elemento contém, por exemplo, oxigênio e ozônio, que são compostos de moléculas cuja atomicidade é de 2(O2) e 3(O3), e acontece também entre o fósforo branco (P4), e fósforo vermelho (Pn).
- na estrutura cristalina – ocorre com o diamante e com a grafita, os átomos da grafita liga-se a três átomos, e no diamante cada átomo liga-se a quatro átomos, o que faz com que as camadas fiquem empilhadas. As formas alotrópicas do enxofre têm suas moléculas organizadas de formas diferentes.
Em relação aos diamantes, cada átomo está ligado a outros 4 átomos, já na grafia, cada átomo se liga à 3 outros átomos.
Propriedades físicas
Existem alguns dados que diferem propriedades físicas dos alótropos dos elementos. Vejamos:
- O gás oxigênio é incolor, insípido e inodoro, possui uma densidade: 1,429 g/L, sua temperatura e sua pressão são normais (TPN) 218,8 ºC, graus de fundição, e 183,0 ºC, grau de ebulição.
- Diferente do gás ozônio, azul pálido, odor irritante. Densidade 2,144 g/L, temperatura e pressão normais (TPN), 249,6 ºC, grau de fundição, 112,3 ºC, grau de ebulição.
Propriedades químicas
Podemos notar que os aspectos energéticos e a velocidade que as reações ocorrem, diferem às propriedades químicas.
Por exemplo, os dois tipos de fósforos tanto a o vermelho quanto o branco, reagem com oxigênio em excesso provocando a formação de anidrido fosfórico; cloro provocando a formação de cloretos, entre outros.
Entretanto, é válido lembrar que a propriedade branca reage mais rapidamente que a vermelha. O diamante e a grafita, também reagem com o oxigênio, provocando a formação de gás carbônico, porém o aquecimento do diamante libera mais energia que a grafita.
Estabilidade dos alótropos
A grafita entende-se como sendo mais estável que diamante, o gás oxigênio é mais estável que ozônio. Isso acontece porque as os formatos alotrópicos mais estáveis estão presentes na natureza em maior quantidade.
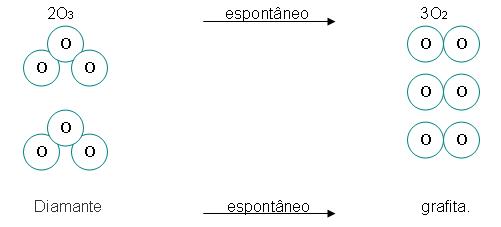
Para obter o processo inverso, é recomendado o dispêndio de energia. Vejamos:
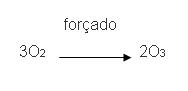
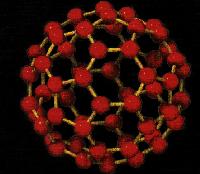
Fulerenos
São moléculas de carbono, que contém 60 átomos, divididos de forma que parece uma esfera, contendo 12 pentágonos e 20 hexágonos. Essa molécula é denominada buckyball. Foram descobertas também outras moléculas (C90, C120, entre outras) que são denominadas fulerenos.
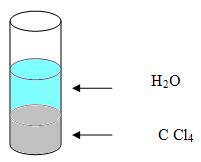
5. Materiais homogêneos e heterogêneos
Introdução
Para podermos definir a aparência de um material, devemos determinar todos os detalhes possíveis de se perceber, porém isso irá depender da forma que o material irá ser observado, pois se olharmos uma parede feita de tijolos de longe, iremos perceber que ela é uniforme, já se olharmos essa parede de perto ela não será uniforme, pois de longe ela dará a impressão de uma parede feita de um material avermelhado, ou seja, não será possível observar os detalhes, já de perto sim, os detalhes são notáveis, por isso que ela deixa de ser uniforme.
Os materiais são divididos em dois grupos, vejamos:
Material homogêneo
Todo material que apresenta um aspecto uniforme quando é observado através de um ultramicroscópio, é considerado um material homogêneo.
Material heterogêneo
Todo material que não apresenta as mesmas propriedades em toda a sua extensão, quando observado por um ultramicroscópio, é considerado um material heterogêneo.
Fase
São fragmentos de materiais homogêneos que fazem parte de um mesmo material heterogêneo.
Podemos notar que os aspectos energéticos e a velocidade que as reações ocorrem, diferem às propriedades químicas.
Por exemplo, os dois tipos de fósforos tanto a o vermelho quanto o branco, reagem com oxigênio em excesso provocando a formação de anidrido fosfórico; cloro provocando a formação de cloretos, entre outros.
Entretanto, é válido lembrar que a propriedade branca reage mais rapidamente que a vermelha. O diamante e a grafita, também reagem com o oxigênio, provocando a formação de gás carbônico, porém o aquecimento do diamante libera mais energia que a grafita.
Estabilidade dos alótropos
A grafita entende-se como sendo mais estável que diamante, o gás oxigênio é mais estável que ozônio. Isso acontece porque as os formatos alotrópicos mais estáveis estão presentes na natureza em maior quantidade.

Para obter o processo inverso, é recomendado o dispêndio de energia. Vejamos:

Fulerenos
São moléculas de carbono, que contém 60 átomos, divididos de forma que parece uma esfera, contendo 12 pentágonos e 20 hexágonos. Essa molécula é denominada buckyball. Foram descobertas também outras moléculas (C90, C120, entre outras) que são denominadas fulerenos.

5. Materiais homogêneos e heterogêneos
Introdução
Para podermos definir a aparência de um material, devemos determinar todos os detalhes possíveis de se perceber, porém isso irá depender da forma que o material irá ser observado, pois se olharmos uma parede feita de tijolos de longe, iremos perceber que ela é uniforme, já se olharmos essa parede de perto ela não será uniforme, pois de longe ela dará a impressão de uma parede feita de um material avermelhado, ou seja, não será possível observar os detalhes, já de perto sim, os detalhes são notáveis, por isso que ela deixa de ser uniforme.
Os materiais são divididos em dois grupos, vejamos:
Material homogêneo
Todo material que apresenta um aspecto uniforme quando é observado através de um ultramicroscópio, é considerado um material homogêneo.
Material heterogêneo
Todo material que não apresenta as mesmas propriedades em toda a sua extensão, quando observado por um ultramicroscópio, é considerado um material heterogêneo.
Fase
São fragmentos de materiais homogêneos que fazem parte de um mesmo material heterogêneo.

6. Os estados de agregação da matéria
Sólido, líquido e gasoso, esse são os três estados físicos da matéria.
a matéria quando está no seu estado sólido, contém forma e volume definido. Quando no estado líquido, ela apresenta volume constante, e a forma varia de acordo com o recipiente que ela está, ou seja, não contém uma forma concreta.
A partir da terceira figura podemos observar que, quando ela está no estado gasoso ela não contém forma concreta nem volume definido.
7. As mudanças de estado físico
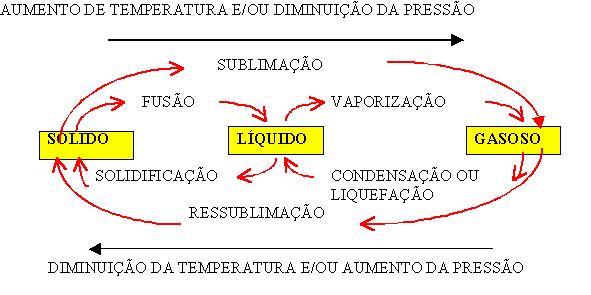 A fusão é quando ocorre a passagem do estado sólido para o líquido, para isso é necessário esquentar o material.
A fusão é quando ocorre a passagem do estado sólido para o líquido, para isso é necessário esquentar o material. A solidificação é quando acontece a passagem do estado líquido para o estado sólido, para isso o material deve ser resfriado.
A vaporização é quando ocorre a passagem do estado líquido para o estado gasoso, ela pode ocorrer através de três formas:
- Através da evaporação: o líquido passa pelo processo de vaporização de forma bem devagar até alcançar a temperatura ambiente.
- Através da ebulição: o líquido passa pelo processo de vaporização de forma acelerada, promovendo a formação de bolhas devido ao aquecimento.
- Através da calefação: o líquido passa pelo processo de vaporização de forma muito acelerada, devido a alta temperatura acima da temperatura necessária para a ebulição.
A condensação: ocorre quando um material que está no estado gasoso, passa para o estado líquido, acontece com o resfriamento dos vapores.
A sublimação: ocorre quando um material que esta no estado sólido, passa para o estado gasoso, um exemplo dessa passagem é o gelo seco. A inversão desse processo é o chamado de ressublimação.
8. Mudança de estado de substância pura e mistura
Introdução
Para diferenciarmos a mistura da substância pura, é só observarmos o comportamento de cada uma na hora do aquecimento, sob a pressão constante, pois é a partir do aquecimento de um líquido que podemos ver se é ou não uma substância pura.
Substância pura
A temperatura de uma substância se mantém constante quando o seu estado físico é alterado. Quando gelo é aquecido a temperatura varia a medida que o tempo passa.
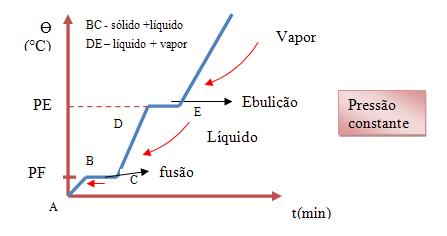
Onde PF é = ponto de fusão e PE é = ponto de ebulição.
Mistura comum
A temperatura de uma mistura não permanece constante durante todo o processo da mudança de estado. Vejamos agora dois gráficos, um que nos mostra a solidificação de água salgada, e outro que nos mostra o aquecimento de água doce:
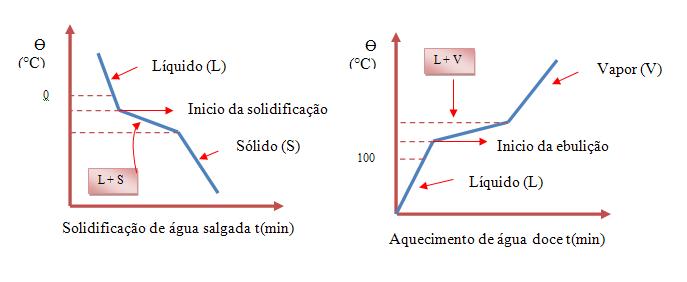
Com isso podemos concluir que uma mistura comum, pode apresentar tanto ponto de fusão, como ponto de ebulição, ambos podendo ser variáveis.
Mistura especiais
Podem ser chamadas de misturas eutéticas ou eutético e azeotrópicas ou azeotrópicos, são misturas que durante a fusão, solidificação, ebulição e condensação, se portam como substâncias puras.
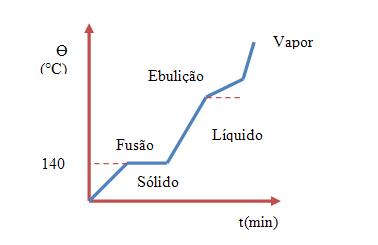
- Misturas eutéticas
Com relação à fusão e à solidificação, as misturas eutéticas, se portam exatamente como fossem as substâncias puras, ou seja, elas têm o seu ponto de fusão constante.
Observando o topo das fusões, notamos que a temperatura da fusão de um eutético é inferior com relação à dos seus componentes.
Observe o exemplo:
Cádmio (40%) e bismuto (60%)
Cádmio puro PF = 320ºC
Bismuto puro PF = 280ºC
Eutético PF = 140ºC
(P.F, ponte de fusão)
Vejamos o gráfico abaixo:
- Misturas azeotrópicas
Essas misturas se portam como substâncias puras, no processo de ebulição, portanto seu ponto de ebulição é constante. Quando se tem uma mistura de 4% de água com 96% de álcool é considerada uma mistura azeotrópica, permanecendo constante durante todo o processo de ebulição, sem que o sistema se desfaça em seus componentes.
Observe o exemplo:
Álcool (96%) e água (4%)
Água pura PE = 100ºC
Álcool puro PE = 78,3ºC
Mistura azeotrópica PE = 78,2ºC
(P.E, ponte de ebulição)
9. Separação de misturas
Análise imediata
Essa análise é considerada a união de processos usados na separação dos componentes existentes tanto nas misturas heterogêneas, como nas misturas homogêneas. É importante lembrar que esses processos são inalteráveis, portanto as moléculas e os íons que compõe as espécies químicas que fazem parte da formação das misturas, não se alteram.
Separação dos componentes de misturas heterogêneas
- Flotação ou sedimentação fracionada
No processo de flotação, é utilizado um líquido com densidade intermediária às dos outros componentes, fazendo com que o componente com menor densidade na mistura flutue, e o mais denso não flutuem, isso tudo sem modificar a estrutura dos componentes dessa mistura, por exemplo, água e serragem.
A flotação é bastante comum no processo de separação de areia e mineral, esses minerais para que possam se tornam menos densos que a areia, ficam envolvidos em óleo.

água e serragem
- Filtração
No processo de filtração, é utilizado o filtro (uma espécie de superfície porosa), ele funciona separando sólido do líquido. O material na qual o filtro é construído, varia de acordo com o componente que será filtrado, se o material for corrosivo o filtro pode ser de algodão, de vidro ou de porcelana porosa.
Existem dois tipos de filtração, a filtração simples e a filtração sob pressão reduzida.
- Dissolução fracionada
A dissolução fracionada é feita a partir de dois processos, a princípio é dissolvida apenas um dos componentes, e para separar o componente dissolvido no líquido do componente não dissolvido, e mistura passa pelo processo de filtração, e o componente dissolvido pode ser separado por destilação. Existe também um processo denominado extração, que é quando ocorre a separação da substância de um material por dissolução em um solvente, por exemplo, água quente no café.
- Decantação
Esse processo é bastante comum na separação de líquidos imiscíveis. Para a decantação é necessário que os componentes sólidos da mistura estejam no fundo do recipiente, depois se coloca um recipiente vazio ao lado do recipiente com a mistura, e com a ajuda de um sifão é possível retirar o liquido sem retirar o componente sólido.
Vejamos a ilustração abaixo:
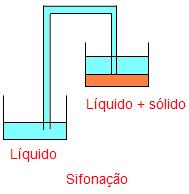
Outra forma de decantação e através do funil de bromo, a mistura deve estar em repouso, nesse funil existe uma espécie de torneira por onde são retirados os elementos sólidos.
- Fusão fracionada
Na fusão fracionada, utilizamos dois processos, a princípio a mistura é aquecida até o ponto de fusão de algum dos seus componentes que assim atingirá o estado líquido, após esse processo, esse componente pode ser separado pelo processo de decantação.
- Sublimação
A sublimação é a passagem direta do estado sólido para o gasoso, é utilizada para o processo de purificação tanto do iodo como do naftaleno.
- Separação magnética
É utilizada para separar componentes que se atraem por imãs, como por exemplo, partículas de ferro misturadas com enxofre em pó.

- Levigação
Esse sistema ocorre quando, um componente menos denso é arrastado pela água e outro componente mais denso permanece, exemplo desse processo é a levigação, utilizada para separar ouro e areia.
- Fusão fracionada
Na fusão fracionada, utilizamos dois processos, a princípio a mistura é aquecida até o ponto de fusão de algum dos seus componentes que assim atingirá o estado líquido, após esse processo, esse componente pode ser separado pelo processo de decantação.
- Sublimação
A sublimação é a passagem direta do estado sólido para o gasoso, é utilizada para o processo de purificação tanto do iodo como do naftaleno.
- Separação magnética
É utilizada para separar componentes que se atraem por imãs, como por exemplo, partículas de ferro misturadas com enxofre em pó.

- Levigação
Esse sistema ocorre quando, um componente menos denso é arrastado pela água e outro componente mais denso permanece, exemplo desse processo é a levigação, utilizada para separar ouro e areia.
- Cristalização fracionada
A cristalização fracionada é um processo em que os componentes da mistura são dissolvidos na água e consequentemente sujeitos à evaporação. Após esse processo, toda a solução irá se tornar saturada o que resultará na cristalização dos componentes, esse processo é utilizado para a separação do sal da água do mar.
- Tratamento da água
Para que a água de uma cidade seja tratada, ocorrem vários processos. Vejamos a ilustração abaixo:
Vejamos cada um deles:
A peneiração é responsável por impedir que objetos, e peixes, não penetrem na instalação, pois se isso ocorrer poderá causar danos ao processo.
A pré-cloração é responsável pela eliminação de microorganismos, utilizando o cloro (Cl1).
A floculação é processo que lida com as partículas sólidas, é necessário sulfato de alumínio, hidróxido de alumínio, para que as partículas se tornem flocos.
A decantação é responsável pela sedimentação dos flocos sólidos.
A filtração possui um filtro composto por areia, que mantêm todas as partículas sólidas que restaram.
A pós-cloração é responsável por manter a água limpa, colocando uma quantidade necessária de cloro.
Areação, controle de acidez e fluoretação, esse processo não é obrigatório, pode-se adicionar íons F, responsável para a redução de cáries dentárias.
Separação dos compostos de misturas homogêneas
- Destilação simples
Na destilação simples, a mistura é aquecida, ocorrendo a evaporação do componente líquido, que em seguida irá se condensar, e se depositar em outro recipiente, esse processo é comum em misturas homogêneas.
- Destilação fracionada
A destilação fracionada separa os componentes das misturas, líquido por líquido.
Para obter a separação é necessário aquecer a mistura, cada componente tem diferentes pontos de ebulição, assim é possível separá-los, sendo que esse procedimento deve ser feito em um balão de destilação, um exemplo claro da destilação fracionada é o processo em que o petróleo é dividido.
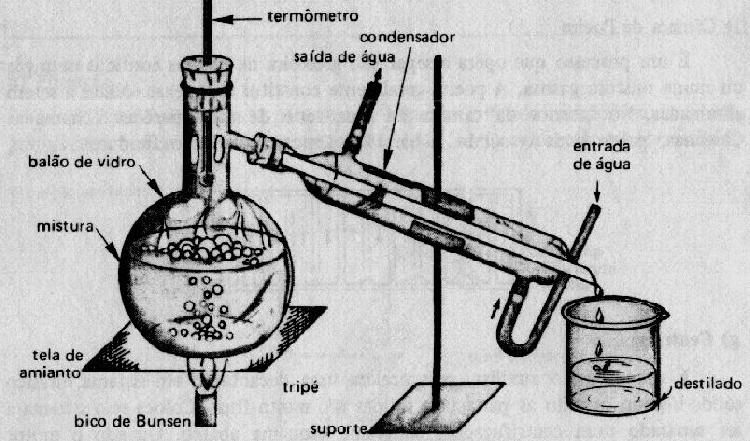
Aparelho de destilação
Aparelho de destilação
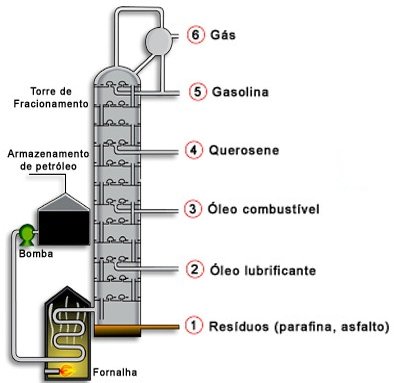
Destilação fracionada do petróleo
10. Fenômeno
Podemos entender fenômeno com sendo qualquer mudança que acorre nos corpos, causadas por agentes químicos ou físicos, pode ser também qualquer mudança que aconteça no universo.
A Classificação dos fenômenos
Os fenômenos são classificados em: fenômenos físicos e fenômenos químicos, porém em alguns casos é possível perceber características do fenômeno físico no fenômeno químico, e vice versa, o que dificulta defini-los.
Fenômeno Físico
O fenômeno físico não altera a composição natural do material.
Exemplo:


É importante lembrar que fusão, ebulição, condensação entre outros estados de agregação são fenômenos físicos.
Fenômeno Químico
O fenômeno químico altera a composição natural do material, fazendo surgir no mínimo uma nova substância.
Exemplo:

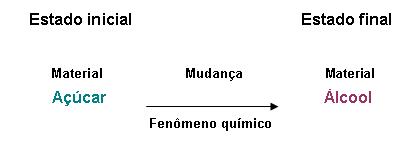
11. Reação química
Definição
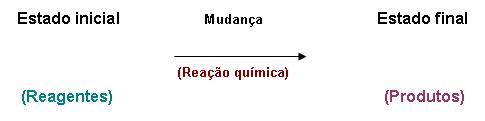
É a transformação química de um reagente em produto, ou seja, é quando acontece um fenômeno químico com uma substância, como vimos anteriormente. É importante ressaltarmos que qualquer fenômeno químico é considerado uma reação química.
Reagentes e produtos
Os reagentes são as substâncias, que estão presentes no inicio da reação, estas que irão sofrer alterações (fenômeno químico).
Os produtos são substâncias que estão presentes no final da reação, eles resultarão em uma reação química.
Observe:
Exemplo de uma reação química:
GÁS HIDROGÊNIO + GÁS OXIGÊNIO
Os dois gases formam uma mistura e através da faísca elétrica é provocada uma reação química entre os gases.
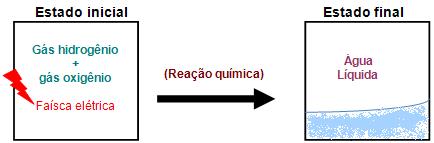
Após o desaparecimento do O (oxigênio) e do H (hidrogênio), depois da reação química, irá surgir a água. Essa reação é denominada reação de combustão.
Equação química
Qualquer reação química tem condições de ser representada por uma equação química.
Vejamos:

Porém, o número de átomos deve igual tanto no estado inicial como no estado final, observe abaixo a forma correta.
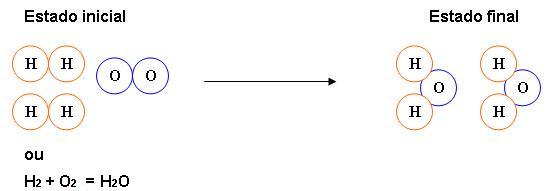
Rearranjo dos átomos em uma reação química
As moléculas são desfeitas dos reagentes, para que dessa forma ocorra uma reação química, ocorrendo assim a formação de outras moléculas.
Exemplos:
- Cada molécula de nitrogênio reage com três moléculas de hidrogênio, resultando em duas moléculas de amônia.
N2(g) + 3H2(g) → 2NH3(g)
- Magnésio metálico queima no ar e produz óxido de magnésio.
2Mg(s) + O2(g) → 2MgO(S)
14. Propriedades dos materiais As propriedades dos materiais se dividem em específicas e gerais.
As propriedades gerais são características comuns em quase todas as substâncias, já as específicas dizem respeito a uma ou um pequeno grupo de substâncias.
Propriedades gerais
A) Extensão
Extensão é todo o espaço ocupado pela matéria.
B) Inércia
É uma propriedade responsável por preservar o movimento ou repouso da matéria uniforme e reto. É importante saber que quanto maior for a massa, maior será a inércia, pois a massa é considerada a medida da inércia.
C) Impenetrabilidade
Essa propriedade diz respeito ao fato de que, dois corpos não podem ocupar o mesmo espaço ao mesmo tempo.
D) Divisibilidade
Essa propriedade diz respeito a divisão de partículas pequenas da matéria, sem que ela perca suas características.
Exemplo:
Açúcar dissolvido em água.
Água dividida em diversos recipientes.
E) Compressibilidade
Essa propriedade diz respeito a diminuição do volume de um corpo. Os gases são os mais fáceis de serem comprimidos.
Propriedades específicas 1ª) Ponto de fusão (PF)
O ponto de fusão é a temperatura em que um material passa do estado sólido para o estado líquido. A temperatura do ponto de fusão de cada material varia.
Observe o exemplo: (1atm)
Nitrogênio FP = - 210ºC.
Álcool comum FP = - 143ºC
Água FP = 0ºC
Cloreto de sódio FP = 801ºC
2ª) Ponto de ebulição (PE)
O ponto de ebulição é a temperatura em que um material passa do estado líquido para o estado gasoso. A temperatura do ponto de ebulição de cada material varia.
Observe o exemplo: (1atm)
Nitrogênio FP = - 196ºC.
Álcool comum FP = - 78ºC
Água FP = 100ºC
Cloreto de sódio FP = 1490ºC
3ª) Densidade absoluta ou massa específica
Como podemos observar na fórmula acima, a densidade é considerada a massa dividida pelo volume. Lembrando que a unidade de medida de sua massa é g/cm3.
Vejamos um exemplo:
• Se colocarmos uma pedra dentro de um copo cheio de água, iremos perceber que a pedra irá afundar, pois a pedra é mais densa que a água.
4ª) Dureza
Essa propriedade mede a resistência dos materiais. Para descobrir se um material é mais duro que o outro é necessário um teste de atrito.
Obs.: O diamante é a substância mais resistente que existe.
Exemplo:
Vamos imaginar uma madeira e um estilete de aço. Este estilete irá riscar a madeira, portanto ele é mais resistente, porém se ao invés de madeira usarmos o quartzo, percebemos que ele é mais forte que o estilete de aço que não risca o quartzo.
5ª) Maleabilidade
Os materiais maleáveis podem ser reduzidos a lâminas, como por exemplo, a prata, o ouro, o zinco, entre outros...
6ª) Ductilidade
Essa propriedade trata dos materiais que podem ser transformados em fio, como por exemplo, o alumínio, o cobre, entre outros...
7ª) Solubilidade
Essa propriedade diz respeito a materiais que se dissolvem e os que não se dissolvem, ou seja, trata de misturas homogêneas e misturas heterogêneas.
Adiciona-se uma pequena quantidade de açúcar em um copo com água, o açúcar se dissolve completamente, logo se dá uma mistura homogênea, porém se adicionarmos areia em um com água, por menor que seja a quantidade ela não vai ser dissolvida, logo se dá uma mistura heterogênea.
Em 100g de água é possível dissolver 220g de açúcar, se a água estiver aquecida a 30ºC e tentarmos dissolver mais que 220g de açúcar o excesso fica depositado no fundo do recipiente.
Vejamos a ilustração:
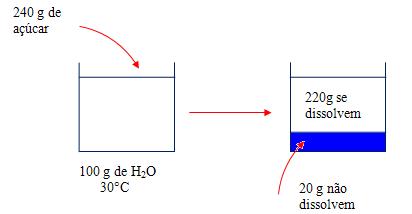
A matéria que se dissolve em máxima quantidade recebe o nome de coeficiente de solubilidade. Essa matéria é dependente da temperatura, pois quando temos 100 gramas de água em uma temperatura de aproximadamente 50ºC, somente 260 gramas de sacarose irão conseguir dissolver. Isso explica o fato do café ser feito somente em água quente, pois ele não é solúvel em fria.
Propriedades organolépticas
São propriedades capazes de impressionar nossos sentidos. Vejamos:
A cor é percebida pela visão, ex.: a mata é verde.
O brilho também é percebido pela visão, ex.: metal polido, por refletir a luz.
O sabor é percebido pelo paladar, ex.: o açúcar é doce.
O odor é percebido pelo olfato, ex.: á água é inodora.
Notas
As propriedades físicas são capazes de identificar algumas soluções, como por exemplo, ponto de ebulição, de fusão, densidade e etc.
As propriedades químicas geralmente não identificam as soluções, pois é preciso que ocorra uma reação química.
A Propriedade Física Intensiva é inseparável à origem do material, como por exemplo, o sabor, a cor, a transparência entre outros.
A Propriedade Física Extensiva é totalmente dependente da quantidade do material, como por exemplo, a massa.
15. Sistemas Consiste na averiguação de uma porção do espaço físico.
Classificação
- Sistema aberto
Nele é possível que a matéria e a energia sejam trocadas com o meio ambiente, por exemplo, a caneta tinteiro.
- Sistema fechado
Nele não há troca de matéria, apenas de energia com o meio ambiente, por exemplo, termômetro químico.
- Sistema isolado
Nele não há nem troca de energia nem de matéria, como por exemplo, um botijão térmico.
12. Pesquisa científica
Método da ciência
Para o método de todas as ciências naturais é de caráter fundamental algumas etapas;
a) Observação do fato
Inicia-se com o fato, por exemplo, madeira queima.
b) Experimentação
Quando e como ocorrem os fatos, como por exemplo, como e quando a madeira ire queimar?
c) Reunião e organização de dados
Quanto foi consumido de ar e madeira
d) Criação de leis e teorias
Qual a relação matemática das quantidades, existente entre o ar e a madeira?
e) Previsão de novos fenômenos e materiais
Se a madeira for aquecida a 500ºC, no que resultará?
Regularidades
Os objetos de madeira queimam; as substâncias puras apresentam ponto ebulição e fusão, ambos constantes. Essas regularidades resultam em algumas generalizações (leis), pelo fato de que elas se baseiam em observações.
Teorias de modelos
Teoria é o conjunto de conhecimento especulativo, ou seja, a explicação de uma arte ou ciência. Nesse caso ela é usada para a explicação dos resultados das etapas a, b, c, d, e, citadas acima.
Observação e interpretação
A observação diz respeito a questões qualitativas e/ou quantitativas, de um fenômeno. Essas questões são averiguadas e descritas.
Vejamos:
- Observação qualitativa
Ao queimar, a vela produz luz e calor, formando um sólido branco (a parafina).
- Observação quantitativa
A vela tem 10 cm de comprimento.
Do sólido branco foi formado 10g.
- A interpretação é uma forma de expor a compreensão, de explicar o que foi observado
13. Material de laboratório
Balão de fundo chato: É utilizado para o aquecimento de soluções e líquidos para promover reações.

Erlenmeyer: É utilizado para dissolução e aquecimento de substâncias e reações entre soluções.

Funil: Não pode ser aquecido, serve para barrar partículas sólidas.

Tubo de ensaio: É utilizado para fazer pequenas reações.
Balão de fundo chato: É utilizado para o aquecimento de soluções e líquidos para promover reações.

Erlenmeyer: É utilizado para dissolução e aquecimento de substâncias e reações entre soluções.

Funil: Não pode ser aquecido, serve para barrar partículas sólidas.

Tubo de ensaio: É utilizado para fazer pequenas reações.

Condensador: Serve para condensar os vapores do líquido.

Bastão ou baqueta: É usado como utensílio de cozinha, feito de vidro, é utilizado para mexer as soluções.

Proveta ou cilindro graduado: Não pode ser aquecido, tem como finalidade medir e transferir volume líquido.

Bureta: É uma espécie de “termômetro”, ao invés de medir temperatura, mede exatamente o volume.
Bastão ou baqueta: É usado como utensílio de cozinha, feito de vidro, é utilizado para mexer as soluções.

Proveta ou cilindro graduado: Não pode ser aquecido, tem como finalidade medir e transferir volume líquido.


Pipeta: Não pode ser aquecida, tem como utilidade medir e transferir pouca quantidade de volume.
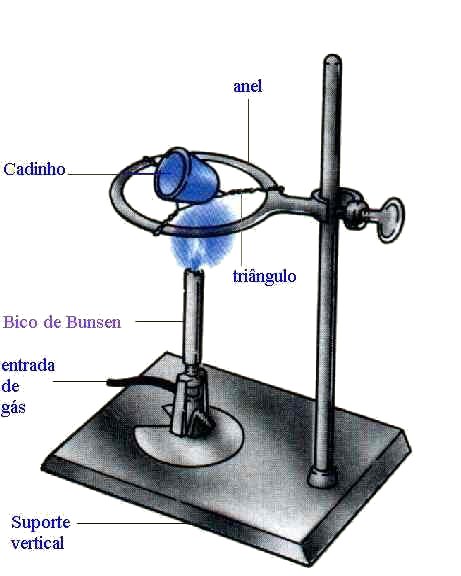
Balão volumétrico: É utilizado para medir o volume com exatidão.

Bico de bunsen: É um aparelho usado para o aquecimento de substâncias em laboratório.

Estufa: Serve para secar e esterilizar os materiais, ela atinge até 200ºC.

Mufla: Atinge até 1500ºC, serve para calcinações.

Cadinho: Objeto utilizado para a calcinação de substâncias.

Suporte universal: É utilizado tanto para segurar os condensadores quanto para sustentar algumas peças.
Pinça simples: Está interligada ao suporte e serve para prender outros utensílios.
Anel ou argola: Serve para segurar o funil durante uma filtração.
Tripé de ferro: É um suporte para aquecimento de substâncias.
Tela de amianto: Sua principal utilidade é distribuir o calor igualmente para as peças que serão aquecidas, ele é colocado em cima do tripé de ferro.
 Almofariz e pistilo: Serve para pulverizar e triturar substâncias sólidas.
Almofariz e pistilo: Serve para pulverizar e triturar substâncias sólidas.
Funil de Buchner e Kitassato: É utilizado para vácuo e filtração.Dessecador: Serve para armazenar substâncias que contenham baixo índice de umidade.
Pisseta: Objeto usado para lavar os materiais e os recipientes com pequenos jatos.
Balão de destilação: Serve para vaporizar líquidos durante a destilação.
Refluxo: É um aparelho que quando usado ocorre a evaporação e a condensação.
Aparelho de Kipp: Serva para a preparação de gases, através de reação de um líquido e um sólido.
http://www.colegioweb.com.br/quimica