Por volta de 2400 anos já se considerava a idéia de que os objetos eram compostos por pequenas partículas que foram nomeadas de átomos, e que eram indivisíveis, essas considerações foram feitas por Leucipo e Demócrito.
Foram feitas diversas experiências, que resultaram na descoberta da radioatividade, na hipótese de que era possível dividir um átomo, e que ele era composto por um núcleo e uma eletrosfera ao redor.
Existem três partículas (fundamentais) de extrema importância; os elétrons (possuem carga elétrica), os prótons (partículas positivas) e os nêutrons (não possuem carga elétrica).
2. As massas das partículas
Os prótons possuem massas maiores que os elétrons, aproximadamente 1840 vezes maior.
Os prótons e os nêutrons possuem massas praticamente iguais.
O que é realmente relevante é o núcleo, porque nele estão os núcleos (prótons e nêutrons).
3. As dimensões do átomo
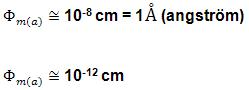
São indicadores dos diâmetros médios do núcleo e do átomo (10.000 vezes maior que o núcleo).
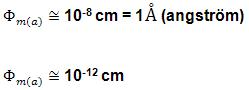
São indicadores dos diâmetros médios do núcleo e do átomo (10.000 vezes maior que o núcleo).
4. A relação entre número de prótons e elétron
O número de prótons é igual ao número de elétrons quando, não há interferência de fatores externos.
Portanto:
np = ne
6. O número atômico (z) É representado por (Z), é usado para indicar o número de prótons contidos dentro do núcleo, esse número atômico caracteriza o átomo, ou seja, não é possível a existência de dois átomos diferentes com o mesmo número atômico.
Por exemplo:
11Na, 17Cl
Átomo de cloro: Z=17
Átomo de sódio: Z=11
Número de massa
Para descobrir o número de massa (A) de um átomo, é necessário somar o número de prótons e nêutrons.
A = N + Z
* onde N é o número de átomos.
Por exemplo:
Vamos usar como exemplo o átomo de sódio, que possui 11 prótons e 12 nêutrons, portanto Z = 11. Logo:
A = 11 + 12 = 23,
23
Na
11
Onde: 23 é o número de massa e 11 é o número atômico.
Elemento químico
São todos os elementos químicos de um átomo com número atômico (Z) igual.
Existem aproximadamente 100 elementos químicos naturais e sintéticos. Onde mais ou menos 90 são elementos químicos naturais, que podemos encontrar na natureza. Já os elementos sintéticos são produzidos de forma artificial.
Gerd Binnig, e Heinrich Rohrer em 1981 inventou um microscópio de varredura. através dele é possivel obter imagens de átomos e moléculas.
Para que ele funcione é necessário utilizar uma agulha de tungtênio, onde passará uma quantidade de tensão elétrica. A agulha desliza pela superfície a ser analizada sem entrar em contato com ele. Quando ela encontra um átomo ocorre uma reação que faz surgir reação elétrica, onde irá promover na tela uma pequena pontinha luminosa. A imagem é aumentada 100 milhões de vezes. Vejamos abaixo um microscópio de varredura:

7. Configuração eletrônica
Relembrando os modelos atômicos: Dalton considerava que a menor porção da matéria era uma partícula esferica indivisivel, que foi denominada de átomo. A partir desse modelo, surgiram outrosm complentares, o modelo orbital foi bastante estudado por Thomson , Ruthergord, Bohr, eles defendiam a concepção de que o átomo não era a menor porção da matéria.
8. Camadas eletrônicas ou níveis energéticos
Existem elétros que estão um pouco mais perto do núcleo, chegamos a essa conclusão pelo fato de que alguns elétrons são mais fáceis de serem removidos que outros. Isso ocorre por que quanto mais perto do núcleo o elétron estiver, mais força da sua energia potenial ele irá perder, e a energia cinética aumenta, aumentando assim sua velocidade.
Isso varia de acordo com a distância em que o elétron está em relação ao núcleo, a medida em que o elétron se movimenta e se afasta do núcleo ele perde energia, essa energia é retornada em forma de radiação, que podemos medir pela cor que varia de acordo com a frequência da energia.
É possível acontecer 7 níveis de energia, e são denominados números quânticos principais, no qual sua função é mostrar a distância entre o elétron e o núcleo. Os números quânticos principais são:
K, L, M, N, O, P, Q ou 1, 2, 3, 4, 5, 6, 7
Na equação de Rydberg, o número de elétron em determinada camada é representado por X e o número quântico principal equivalente a essa camada é representado por n.
Equação: X = 2 . n2
Onde X representa o número de elétrons em certa camada, e n representa o número quântico que corresponde a essa mesma camada.
Observe as camadas com as equações aplicadas:
Se aplica a fórmula até a camada N, e os átomos dos elétrons até o número atômico Z=118. Observe em cada camada há um número máximo de elétrons.
O número máximo de elétrons que a camada O pode ter são 50 elétrons, porém até agora na camada O só há 32 elétrons.
Observe:
Z = 17 A = 35
Número de prótons: Z = 17
Número de elétrons: Z = 17
Número de nêutrons: N = A – Z = 35 – 17 = 18
A distribuição eletrônica
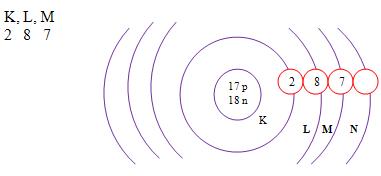
Camada de valência
É representada pela letra M, só tem capacidade para 8 elétros não mais que isso, e é o nível de energia do átomo que mais está no seu exterior.
Regras práticas de distribuição eletrônica
- É necessário organizar na ordem, K, L, M, N, O, P, Q... até Z, que é o número atômico.
- Quando tiver mais que 8 elétrons, na última camada, temos que colocar um número menor entre 2, 8, 18, 32, passando a diferença para o nível seguinte.Lembrando que não pode ter mais que 18 elétrons no penúltima camada.
Observe os exemplos:
1) Número atômico 20
2) Número atômico 53
1808 – Dalton
John Dalton, um professor inglês, propôs a idéia de que as propriedades da matéria podem ser explicadas em termos de comportamento de partículas finitas, unitárias. O átomo seria a partícula elementar, a menor unidade de matéria.
Surgiu, assim, o modelo de Dalton: átomos vistos como esferas minúsculas, rígidas e indestrutíveis. Todos os átomos de um elemento são idênticos.
Primeiro modelo atômico com base experimental. O modelo vingou até 1897.
1897 – Thomson
Descargas elétricas em alto vácuo (tubos de Crookes) levaram à descoberta do elétron. A atribuição de carga negativa aos elétrons foi arbitrária.
Thomson concluiu que o elétron deveria ser um componente de toda matéria, pois observou que a relação carga/massa para os raios catódicos tinha o mesmo valor, qualquer que fosse o gás colocado na ampola de vidro.
O átomo seria uma partícula maciça, mas não indivisível. Seria formado por uma geléia com carga positiva, na qual estariam incrustados os elétrons (modelo do pudim de passas).
1911 – Rutherford
Lorde Rutherford e colaboradores (Geiger e Marsden) bombardearam uma lâmina metálica delgada com um feixe de partículas alfa que atravessava a lâmina metálica sem sofrer desvio na sua trajetória (para cada 10.000 partículas alfa que atravessavam sem desviar, uma era desviada).
Rutherford concluiu que o átomo não era uma bolinha maciça. Admitiu uma parte central positiva muito pequena, mas de grande massa (“o núcleo”) e uma parte envolvente negativa e relativamente grande (“a eletrosfera ou coroa”). Se o átomo tivesse o tamanho do Estádio Vivaldo Lima, o núcleo teria o tamanho de uma azeitona. Surgiu, assim, o modelo nuclear do átomo.
O átomo não é maciço nem indivisível. Seria formado por um núcleo muito pequeno, com carga positiva, onde estaria concentrada praticamente toda a sua massa. Ao redor do núcleo ficariam os elétrons em órbitas circulares, neutralizando sua carga. Este é o modelo do átomo nucleado, um modelo que foi comparado ao sistema planetário, onde o Sol seria o núcleo e os planetas seriam os elétrons.
1913 – Bohr
O modelo planetário de Rutherford apresenta duas falhas:
1. Uma carga negativa, colocada em movimento ao redor de uma carga positiva estacionária, adquire movimento espiralado, acabando por colidir com ela.
2. Essa carga em movimento perde energia, emitindo radiação. Ora, o átomo no seu estado normal não emite radiação.
Em 1913, o físico dinamarquês Niels Bohr expôs uma idéia que modificou o modelo planetário do átomo.
Um elétron num átomo só pode ter certas energias específicas, e cada uma destas energias corresponde a uma órbita particular. Quanto maior a energia do elétron, mais afastada do núcleo se localiza a sua órbita.
Quando um elétron do átomo recebe energia, ele salta para outro nível de maior energia, portanto mais distante do núcleo. Quando o elétron volta para o seu nível de energia primitivo (mais próximo do núcleo), ele cede a energia anteriormente recebida sob forma de uma onda eletromagnética (luz).
1916 – Sommerfeld Existem elétros que estão um pouco mais perto do núcleo, chegamos a essa conclusão pelo fato de que alguns elétrons são mais fáceis de serem removidos que outros. Isso ocorre por que quanto mais perto do núcleo o elétron estiver, mais força da sua energia potenial ele irá perder, e a energia cinética aumenta, aumentando assim sua velocidade.
Isso varia de acordo com a distância em que o elétron está em relação ao núcleo, a medida em que o elétron se movimenta e se afasta do núcleo ele perde energia, essa energia é retornada em forma de radiação, que podemos medir pela cor que varia de acordo com a frequência da energia.
É possível acontecer 7 níveis de energia, e são denominados números quânticos principais, no qual sua função é mostrar a distância entre o elétron e o núcleo. Os números quânticos principais são:
K, L, M, N, O, P, Q ou 1, 2, 3, 4, 5, 6, 7
Na equação de Rydberg, o número de elétron em determinada camada é representado por X e o número quântico principal equivalente a essa camada é representado por n.
Equação: X = 2 . n2
Onde X representa o número de elétrons em certa camada, e n representa o número quântico que corresponde a essa mesma camada.
Observe as camadas com as equações aplicadas:
K | L | M | N | O | P | Q |
2 | 8 | 18 | 32 | 50 | 72 | 98 |
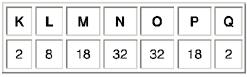
Se aplica a fórmula até a camada N, e os átomos dos elétrons até o número atômico Z=118. Observe em cada camada há um número máximo de elétrons.
| K | L | M | N | O | P | Q |
| 2 | 8 | 18 | 32 | 32 | 18 | 8 |
O número máximo de elétrons que a camada O pode ter são 50 elétrons, porém até agora na camada O só há 32 elétrons.
Observe:
Z = 17 A = 35
Número de prótons: Z = 17
Número de elétrons: Z = 17
Número de nêutrons: N = A – Z = 35 – 17 = 18
A distribuição eletrônica

Camada de valência
É representada pela letra M, só tem capacidade para 8 elétros não mais que isso, e é o nível de energia do átomo que mais está no seu exterior.
Regras práticas de distribuição eletrônica
- É necessário organizar na ordem, K, L, M, N, O, P, Q... até Z, que é o número atômico.
- Quando tiver mais que 8 elétrons, na última camada, temos que colocar um número menor entre 2, 8, 18, 32, passando a diferença para o nível seguinte.Lembrando que não pode ter mais que 18 elétrons no penúltima camada.
Observe os exemplos:
1) Número atômico 20
K | L | M | N |
2 | 8 | 10 | 2 |
8 |
2) Número atômico 53
K | L | M | N | O |
2 | 8 | 18 | 25 | 7 |
18 |
1808 – Dalton
John Dalton, um professor inglês, propôs a idéia de que as propriedades da matéria podem ser explicadas em termos de comportamento de partículas finitas, unitárias. O átomo seria a partícula elementar, a menor unidade de matéria.
Surgiu, assim, o modelo de Dalton: átomos vistos como esferas minúsculas, rígidas e indestrutíveis. Todos os átomos de um elemento são idênticos.
Primeiro modelo atômico com base experimental. O modelo vingou até 1897.
1897 – Thomson
Descargas elétricas em alto vácuo (tubos de Crookes) levaram à descoberta do elétron. A atribuição de carga negativa aos elétrons foi arbitrária.
Thomson concluiu que o elétron deveria ser um componente de toda matéria, pois observou que a relação carga/massa para os raios catódicos tinha o mesmo valor, qualquer que fosse o gás colocado na ampola de vidro.
O átomo seria uma partícula maciça, mas não indivisível. Seria formado por uma geléia com carga positiva, na qual estariam incrustados os elétrons (modelo do pudim de passas).
1911 – Rutherford
Lorde Rutherford e colaboradores (Geiger e Marsden) bombardearam uma lâmina metálica delgada com um feixe de partículas alfa que atravessava a lâmina metálica sem sofrer desvio na sua trajetória (para cada 10.000 partículas alfa que atravessavam sem desviar, uma era desviada).
Rutherford concluiu que o átomo não era uma bolinha maciça. Admitiu uma parte central positiva muito pequena, mas de grande massa (“o núcleo”) e uma parte envolvente negativa e relativamente grande (“a eletrosfera ou coroa”). Se o átomo tivesse o tamanho do Estádio Vivaldo Lima, o núcleo teria o tamanho de uma azeitona. Surgiu, assim, o modelo nuclear do átomo.
O átomo não é maciço nem indivisível. Seria formado por um núcleo muito pequeno, com carga positiva, onde estaria concentrada praticamente toda a sua massa. Ao redor do núcleo ficariam os elétrons em órbitas circulares, neutralizando sua carga. Este é o modelo do átomo nucleado, um modelo que foi comparado ao sistema planetário, onde o Sol seria o núcleo e os planetas seriam os elétrons.
1913 – Bohr
O modelo planetário de Rutherford apresenta duas falhas:
1. Uma carga negativa, colocada em movimento ao redor de uma carga positiva estacionária, adquire movimento espiralado, acabando por colidir com ela.
2. Essa carga em movimento perde energia, emitindo radiação. Ora, o átomo no seu estado normal não emite radiação.
Em 1913, o físico dinamarquês Niels Bohr expôs uma idéia que modificou o modelo planetário do átomo.
Um elétron num átomo só pode ter certas energias específicas, e cada uma destas energias corresponde a uma órbita particular. Quanto maior a energia do elétron, mais afastada do núcleo se localiza a sua órbita.
Quando um elétron do átomo recebe energia, ele salta para outro nível de maior energia, portanto mais distante do núcleo. Quando o elétron volta para o seu nível de energia primitivo (mais próximo do núcleo), ele cede a energia anteriormente recebida sob forma de uma onda eletromagnética (luz).
Modelo das órbitas elípticas para o elétron. Introdução dos subníveis de energia.
1932 – Chadwick
Descoberta do nêutron.
Carga elétrica
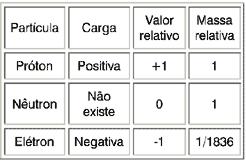
Camadas eletrônicas
Os elétrons estão distribuídos em camadas ou níveis de energia:
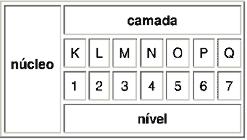
Número máximo de elétrons nas camadas ou níveis de energia:
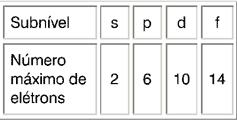
Subníveis de energia
As camadas ou níveis de energia são formados de subcamadas ou subníveis de energia, designados pelas letras s, p, d, f.
Subníveis em ordem crescente de energia:
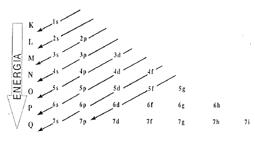
1s 2s 2p 3s 3p 4s 3d 4p 5p 6s 4f 5d 6p 7s 5f 6d
Preenchimento dos subníveis
Os subníveis são preenchidos sucessivamente, na ordem crescente de energia, com o número máximo de elétrons possível em cada subnível.
Os números quânticos indicam a energia do elétron no átomo e a região de máxima probabilidade de se encontrar o elétron.
O número quântico principal (n) indica o nível de energia. Varia de n=1 a n=7, respectivamente, no 1.°, 2.°, 3.°, ... nível de energia.
O número máximo de elétrons em cada nível é dado por 2n2. Entre os átomos conhecidos, no estado fundamental, o número máximo de elétrons num mesmo nível é 32.
O número quântico secundário ou azimutal (l) indica a energia do elétron no subnível. Nos átomos conhecidos, no estado fundamental, há quatro subníveis, representados por s, p, d, f, em ordem crescente de energia.

Orbitais
Os subníveis são formados de orbitais. Orbital é a região da eletrosfera onde há maior probabilidade de estar localizado o elétron do átomo. O número máximo de elétrons em cada orbital é 2. A cada orbital foi atribuído um número quântico magnético (m) cujo valor varia de – 1 a +1, passando por zero.

O orbital s tem forma esférica. Os orbitais p têm forma de duplo ovóide e são perpendiculares entre si (estão dirigidos segundo três eixos ortogonais x, y e z).
Spin
Spin é o movimento de rotação do elétron em torno de seu eixo. Pode ser paralelo ou antiparalelo. A cada um deles foi atribuído um número quântico: + 1/2 e –1/2.
Princípio da exclusão de Pauli
Em um mesmo átomo, não existem dois elétrons com quatro números quânticos iguais.
Como conseqüência desse princípio, dois elétrons de um mesmo orbital têm spins opostos.
Um orbital semicheio contém um elétron desemparelhado; um orbital cheio contém dois elétrons emparelhados (de spins opostos).
Regra de Hund
Ao ser preenchido um subnível, cada orbital recebe, inicialmente, apenas um elétron; somente depois de o último orbital ter recebido seu primeiro elétron começa o preenchimento de cada orbital semi-cheio com o segundo elétron.
Elétron de maior energia ou elétron de diferenciação é o último elétron distribuído no preenchimento da eletrosfera, de acordo com as regras estudadas.

Nenhum comentário:
Postar um comentário