Raios catódicos
Os gases (ar e etc.), não são bons condutores de energia, porém se estiverem em um recipiente fechado eles funcionam com um fluxo maior de energia, pois com menos pressão eles se tornam ótimos condutores de eletricidade.
Vejamos, por exemplo, como funciona um letreiro de neônio:
É composto por um tubo de vidro com gás neônio, com baixa pressão, a cor da luz que esse gás produz ao conduzir eletricidade varia de acordo com a origem do gás.
Essa luz que aparece quando o gás conduz eletricidade, só é possível se a pressão gasosa for de aproximadamente 0,001atm, já se diminuir a pressão essa luz não aparecerá, mas a eletricidade continuará a ser conduzida.
Vejamos uma ampola de Crookes sendo utilizada no estudo da descarga em alto vácuo:
O raio catódico, ele foi denominado assim por que o fluxo de energia se locomove a partir do eletrodo negativo, que é denominado cátodo, em uma linha reta.
Raios anódicos, positivos, canais

Eugen Goldstein
Eugen Goldstein, no ano de 1886, utilizou o aparelho ilustrado abaixo, e se deu conta de que havia uma mancha luminosa perto do eletrodo negativo, a partir de análises ele concluiu que essa mancha luminosa era resultado de um fluxo positivo de cargas.
Raios anódicos, positivos, canais

Eugen Goldstein
Eugen Goldstein, no ano de 1886, utilizou o aparelho ilustrado abaixo, e se deu conta de que havia uma mancha luminosa perto do eletrodo negativo, a partir de análises ele concluiu que essa mancha luminosa era resultado de um fluxo positivo de cargas.
Acontece que os elétrons que fazem parte dos raios catódicos vão de encontro com as moléculas do gás, tirando os elétrons e fazendo surgir íons positivos. Vejamos um exemplo com o gás hidrogênio (formando íons H+ e H+2).
2. Carga do elétron, experiência de MillikanEsse aparelho foi utilizado por Millikan para determinar o valor da carga do elétron:
O valor da carga do elétron, foi definido por Robert Millikan no ano de 1909. Ele utilizou pequenas gotas de óleo no mei de duas placas carregadas. Pelo fato de existir a gravidade, as gotas de óleo visavam se sedimentar. Como as gotas receberam cargas negativas por causa da atração da placa superior positiva, elas conseguiram subir novamente. Após medir a velocidade de elevação e a carga dessa pequena gota, descobriu-se que os valores eram sempre múltiplos do mesmo número, que foi concluído como 1,602 x 10-19 Coulomb (C), onde esse número representa a menor carga de uma gotícula. Portanto Millikan considerou que esse número era o valor da carga de um elétron.
3. O átomo nuclear, experiência de Rutherford
Físico e químico neozelandês, alterou o modelo de átomo proposto por J.J.Thomson, com a afirmação da existência do núcleo atômico, com partículas alfa de átomos de azodo, por bombardeamento ele conseguiu átomos de oxigênio, e foi criador do modelo planetário, ele utilizou partículas alfas para esse bombardeamento, pois não é possível vê-las, mas produzem uma espécie de luz quando entram em contato com anteparos cobertos de sulfeto de zinco, o que torna possível visualizá-las.
Rutherford observou como as partículas alfas reagiam, e concluiu que elas atravessavam a lâmina metálica, ele percebeu que durante esse trajeto, algumas partículas desviavam-se, outras retornavam como se tivessem sido refletidas.
A partir desta análise, Rutherford afirma que a lâmina era composta de átomos que não eram compactos, mas sim a massa que eles formavam eram compactas.
Logo a partir dessas análises e pesquisas, Rutherford percebeu que o átomo é composto por duas partes, sendo uma como o centro denso, carregado positivamente e a outra que parte que é menos densa e grande, totalmente envolvente desse núcleo.
Físico e químico neozelandês, alterou o modelo de átomo proposto por J.J.Thomson, com a afirmação da existência do núcleo atômico, com partículas alfa de átomos de azodo, por bombardeamento ele conseguiu átomos de oxigênio, e foi criador do modelo planetário, ele utilizou partículas alfas para esse bombardeamento, pois não é possível vê-las, mas produzem uma espécie de luz quando entram em contato com anteparos cobertos de sulfeto de zinco, o que torna possível visualizá-las.
Rutherford observou como as partículas alfas reagiam, e concluiu que elas atravessavam a lâmina metálica, ele percebeu que durante esse trajeto, algumas partículas desviavam-se, outras retornavam como se tivessem sido refletidas.
A partir desta análise, Rutherford afirma que a lâmina era composta de átomos que não eram compactos, mas sim a massa que eles formavam eram compactas.
Logo a partir dessas análises e pesquisas, Rutherford percebeu que o átomo é composto por duas partes, sendo uma como o centro denso, carregado positivamente e a outra que parte que é menos densa e grande, totalmente envolvente desse núcleo.
4. Espectros Pela dimensão da onda (λ), podemos observar a ordem da classificação das ondas eletromagnéticas.

Com os estudos feitos sobre a luz causada por substâncias, começaram a aparecer as novas teorias a respeito da estrutura do átomo.
Se observarmos a fundo uma luz branca, iremos perceber que ela é composta por várias cores, ao passar por um prisma de vidro. Vejamos a ilustarção abaixo:

Com os estudos feitos sobre a luz causada por substâncias, começaram a aparecer as novas teorias a respeito da estrutura do átomo.
Se observarmos a fundo uma luz branca, iremos perceber que ela é composta por várias cores, ao passar por um prisma de vidro. Vejamos a ilustarção abaixo:
Na figura a luz é produzida por um filamento de tungstênio de uma lâmpada. O espectroscópio funciona da seguinte forma: a passagem da luz branca direcionada para o prisma que desvia as diferentes cores separando-as e refletindo-as.
Existem dois tipos de espectro: Vejamos:
Espectro contínuo: é quando ele é produzido por materiais sólidos incandescentes, como o exemplo do espectroscópio que foi citado, no qual podemos observar pela figura acima, que as cores ficam contínuas entre, ultravioleta e infravermelho.
Espectro linear: é quando ele é produzido por qualquer gás, que produz luz, as cores aparecem como linhas, divididas por pequenas áreas escuras, por isso os átomos só podem emitir certas energias observe a figura abaixo:
Existem dois tipos de espectro: Vejamos:
Espectro contínuo: é quando ele é produzido por materiais sólidos incandescentes, como o exemplo do espectroscópio que foi citado, no qual podemos observar pela figura acima, que as cores ficam contínuas entre, ultravioleta e infravermelho.
Espectro linear: é quando ele é produzido por qualquer gás, que produz luz, as cores aparecem como linhas, divididas por pequenas áreas escuras, por isso os átomos só podem emitir certas energias observe a figura abaixo:
6. Teoria dos quanta
 Max Karl Ernst Ludwig Planck
Max Karl Ernst Ludwig Planck
Max Karl Ernst Ludwig Planck, físico alemão, conhecido como o pai da física quântica. Na teoria dos quanta, ele afirmava que a emissão e a absorção de energia de um corpo, ocorrem de forma interrompida, como se fossem “pequenos pacotes” denominados quantum ou fóton.
O quantum ou fóton possuem energia específica e fazem parte da radiação, cada fóton varia de acordo com a cor de sua luz. A energia de um fóton ocorre através da relação: E = hf, na qual h é a invariável de Planck:
6, 6262 x 10-34 Js, onde f é a freqüência.
 Max Karl Ernst Ludwig Planck
Max Karl Ernst Ludwig PlanckMax Karl Ernst Ludwig Planck, físico alemão, conhecido como o pai da física quântica. Na teoria dos quanta, ele afirmava que a emissão e a absorção de energia de um corpo, ocorrem de forma interrompida, como se fossem “pequenos pacotes” denominados quantum ou fóton.
O quantum ou fóton possuem energia específica e fazem parte da radiação, cada fóton varia de acordo com a cor de sua luz. A energia de um fóton ocorre através da relação: E = hf, na qual h é a invariável de Planck:
6, 6262 x 10-34 Js, onde f é a freqüência.
7. Os postulados de Niels Bohr para o átomo de hidrogênio
- Postulado de número um
Os elétrons se movimentam em órbitas circulares ao redor do núcleo atômico que está no centro.
- Postulado de número dois
Um quantum de energia é absorvido ou emitido, quando os elétrons se transportam de uma órbita para outra.
Os saltos quânticos acontecem devido à absorção de energia que forçam os elétrons a se deslocarem para posições mais enérgicas do átomo, e após isso os elétrons retornam e devolvem a energia que receberam, sendo a mesma energia que foi absorvida, observe:
Ef– Ei = hf = E
Se E < 0 .......... Energia emitida
Se E < 0 .......... Energia absorvida
O que determina como a energia será devolvida é o valor da diferença de Ef - Ei, sendo h constante, caso a dissemelhança for muito grande será necessário a devolução em formato de alta freqüência de radiação, se for pequena a diferença de energia deve ser pequena a freqüência, e assim por diante.
- Postulado de número três
Apenas algumas órbitas eletrônicas são autorizadas, e os elétrons não propagam energia quando as percorrem.
O número quântico principal é aquele que está relacionado com todas as órbitas permitidas, onde esse número pode variar de 1 a 7.
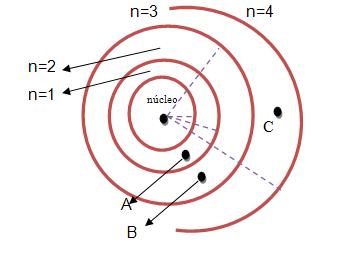
Para efetuar um salto quântico, observe a figura, se os elétrons passarem pelas posições que não são autorizadas A, B e C eles irradiaram energia.
- Postulado de número um
Os elétrons se movimentam em órbitas circulares ao redor do núcleo atômico que está no centro.
- Postulado de número dois
Um quantum de energia é absorvido ou emitido, quando os elétrons se transportam de uma órbita para outra.
Os saltos quânticos acontecem devido à absorção de energia que forçam os elétrons a se deslocarem para posições mais enérgicas do átomo, e após isso os elétrons retornam e devolvem a energia que receberam, sendo a mesma energia que foi absorvida, observe:
Ef– Ei = hf = E
Se E < 0 .......... Energia emitida
Se E < 0 .......... Energia absorvida
O que determina como a energia será devolvida é o valor da diferença de Ef - Ei, sendo h constante, caso a dissemelhança for muito grande será necessário a devolução em formato de alta freqüência de radiação, se for pequena a diferença de energia deve ser pequena a freqüência, e assim por diante.
- Postulado de número três
Apenas algumas órbitas eletrônicas são autorizadas, e os elétrons não propagam energia quando as percorrem.
O número quântico principal é aquele que está relacionado com todas as órbitas permitidas, onde esse número pode variar de 1 a 7.

Para efetuar um salto quântico, observe a figura, se os elétrons passarem pelas posições que não são autorizadas A, B e C eles irradiaram energia.
8. Níveis energéticos e distribuição eletrônica
Para obter a energia total (Et) de um elétron, é necessário somar a energia potencial (Ep) e a energia cinética (Ec), logo:
Et = Ep + Ec
Logo a energia total é:
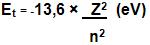
Notas:
1- A unidade de energia O e V, ou seja, elétron-volt, possui o seguinte valor em Joule:
1 e V = 1,602 × 10-19 j
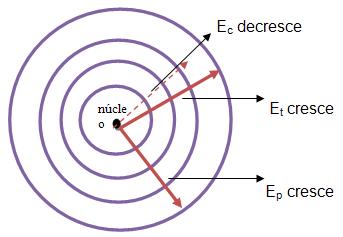
- É importante citar que a energia potencial e total crescem para a periferia do átomo e a energia cinética decresce neste sentido, Se o nível for distante a energia total é por ajuste igual a zero, o que explica o motivo do sinal de menos (-) na equação acima. Vejamos:
Observe abaixo, o diagrama enegético para o hidrogênio (Z = 1), estipulando para n os valores 1,2,3... , que foi concedido através da equação que concede a energia total.
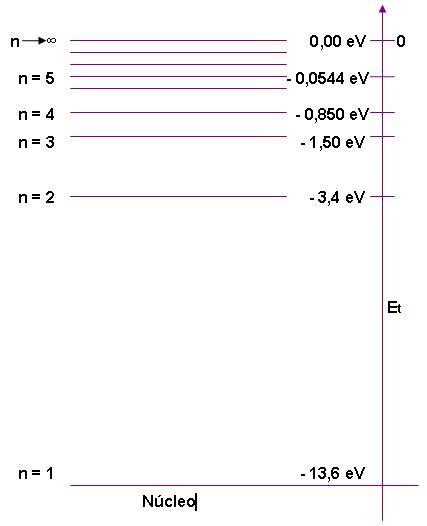
Observe agora como ficam as energias dos estados eletrônicos:

O elétron está separado do núcleo quando n = ∞, e a energia do elétron é
zero.
Quando os elétrons de um átomo indicam energias muito baixas, concluimos que o átomo se encontra em seu estado normal, porém, caso ocorra uma absorção de energia nesse estado normal, n terá valor maior, entretanto, é possível que o átomo possa voltar ao estado normal e liberar energia.
Algumas considerações importantes:
- Caso o elétron do primeiro nível receba 1 quantum de 10,2 eV, ele irá para o segundo nível. Ao voltar para o primeiro nível, lançará 1 quantum de10,2 eV.
- Caso o elétron do primeiro nível receba 1 quantum de 12,1 eV, ele irá para o terceiro nível diretamente.
- Elétrons no primeiro nível não podem receber 1 quantum de 9 eV nem de 11 eV.
- Para arrancar o elétron do átomo, é preciso uma energia mínima de 13,6 eV.
Para obter a energia total (Et) de um elétron, é necessário somar a energia potencial (Ep) e a energia cinética (Ec), logo:
Et = Ep + Ec
Logo a energia total é:
Notas:
1- A unidade de energia O e V, ou seja, elétron-volt, possui o seguinte valor em Joule:
1 e V = 1,602 × 10-19 j
- É importante citar que a energia potencial e total crescem para a periferia do átomo e a energia cinética decresce neste sentido, Se o nível for distante a energia total é por ajuste igual a zero, o que explica o motivo do sinal de menos (-) na equação acima. Vejamos:

Observe abaixo, o diagrama enegético para o hidrogênio (Z = 1), estipulando para n os valores 1,2,3... , que foi concedido através da equação que concede a energia total.

Observe agora como ficam as energias dos estados eletrônicos:

O elétron está separado do núcleo quando n = ∞, e a energia do elétron é
zero.
Quando os elétrons de um átomo indicam energias muito baixas, concluimos que o átomo se encontra em seu estado normal, porém, caso ocorra uma absorção de energia nesse estado normal, n terá valor maior, entretanto, é possível que o átomo possa voltar ao estado normal e liberar energia.
Algumas considerações importantes:
- Caso o elétron do primeiro nível receba 1 quantum de 10,2 eV, ele irá para o segundo nível. Ao voltar para o primeiro nível, lançará 1 quantum de10,2 eV.
- Caso o elétron do primeiro nível receba 1 quantum de 12,1 eV, ele irá para o terceiro nível diretamente.
- Elétrons no primeiro nível não podem receber 1 quantum de 9 eV nem de 11 eV.
- Para arrancar o elétron do átomo, é preciso uma energia mínima de 13,6 eV.
9. Teoria ondulatória do elétron ou noções de mecânica ondulatória
Sabemos que é comum para alguns físicos a consideração de que a luz é como um movimento de partículas minúsculas ou como movimentação de uma onda. Por volta de 1924 Louis de Broglie propõs que o elétron poderia ser explicado como a luz, considerariamos então que um elétron em uma órbita de uma energia, iria obter um comprimento de onda particular.
Observe abaixo a expressão matemática dessa teoria:
p=h/λ, onde:
p = quantidade de movimento do elétron
λ = comprimento de onda associado
h = constante de Planck
No ano de 1927, Davisson Germer firma a teoria de Broglie. Nesta mesma época foi criado o Príncipio da Incerteza, por Wrner Heisenberg.
A quantidade de movimento e a posição de um elétron não pode ser prognosticada, ao mesmo tempo.
Não existe exatidão nas posições de um elétron, mas sim a noção de probabilidade.
Erwin Rudolf Josef Alexander Schrödinger, físico austríaco e Paul Adrien Maurice Dirac, engenheiro e matemático britânico, firmaram no mesmo período equações, na qual descrevia o movimento ondulatório do elétron. Para indicar a extensão da onda utiliza-se ψ.
Em seguida Born, conclui que ψ2, estava associado com a probabilidade de encontrar-se com os elétrons.
10. Partículas subatômicas
As partículas subatômicas refere-se a particulas minúsculas, ou seja, particulas menores que o átomo, além das esseciais, que são: prótons, nêutrons e elétrons.
Sabe-se da existência de dezenas dessas partículas, observe a tabela abaixo:
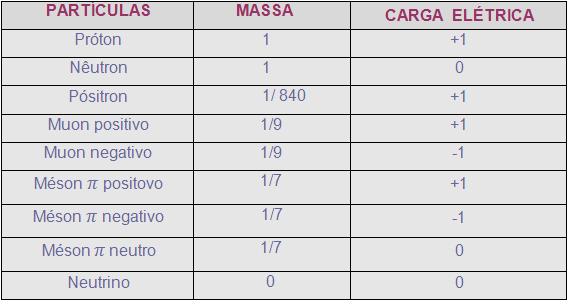
Pósitron ou elétron positivo contém sua massa igual à massa do elétron e sua carga também, porém o sinal é oposto.
As massas dos mésons são intermediárias entre as do próton e a do elétron, averigua-se que é responsável por unir prótons e nêutrons no núcleo.
Neutrinos não possuem partículas significativas de massa e sua carga elétrica é nula. Sua formação provável é: nêutron – próton + elétron + neutrino.
Quando um pósitron agrega-se a um elétron, significa que duas partículas de polaridade opostas que se relacionam, na qual a formação de energia aparece em forma de ondas. Vejamos:

A construção de equivalência entre matéria e energia, foi estabelecida por Einstein, observe:
E = m. c2
Onde:
m - massa em quilograma transformada em energia.
E - a energia em joule, produzida pela extinção da massa m.
c – velocidade da luz em metros por segundo – 3 x 108 m/s.
9 x 1013 joules, é energia necessária para levantar mil toneladas numa até uma altura de 10 km. Lembrando que 9 x 1013 se forma em 1 grama de matéria.
Recentemente conclui-se que a antimatéria, é produzida pelas antipartículas, ou seja, pelos antielétrons, pelos antiprótrons e pelos antinêutrons.
Foi possível obter o anti-hidrogenio, com isolamento e áreas magnéticas, ele foi formado por antipróton, núcleo e antielétron. Vejamos: 3

Teoria de Quarks
Quarks é um dos elementos fundamentais que formam a matéria, outro elemento fundamental é o lépton onde podemos encontrar o elétron.
Sabe-se que os quarks são seis:
1)“Up” (para cima) com carga de + 2/3, e 2)“down” (para baixo) com carga de – 1/3 constituem os prótons e os nêutrons.
Observe como é contituído o próton e o nêutrons:
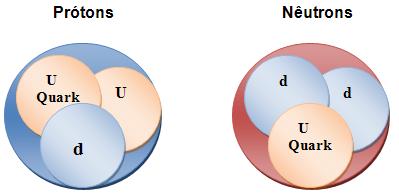
- Para formar o próton há dois “up”, e um “down” .
- Para fortmar o nêutron há dois “down” e um “up”.
3) “Charm” (charme) com carga de + 2/3.
4) “Strange” (estranho) com carga de – 1/3.
Ambos são encontrados nos raios cósmicos.
5) “bottom” com carga de – 1/3.
6) “top” com carga de + 2/3, é aproximadamente 200 vezes mais pesado que um próton, por isso ele não é encontrado nos raios cómicos, nem em fenômenos naturais.
11. Estabilidade do Núcleo
Se tratando da estabilidade do núcleo, podemos dizer que o núcleo possui Z prótons a também A – Z nêutrons apertados em uma região com aproximadamente 10-12cm de raio.
Para podermos explicar essa estabilidade, devemos considerar a conversão de massa em energia. Para entendermos melhor, vamos pensar no núcleo do hélio, que é composto por 2 nêutrons e por 2 prótons. Considerando que a massa de apenas 1 próton é de 1,00732u e a massa de apenas 1 nêutron é de 1,00866u, logo se o núcleo do hélio é composto por 2 prótons e por 2 nêutrons, teremos:
2(1,00866 u) + 2(1,00732 u) = 4,03196 u
Através de algumas experiências, chegou-se a conclusão que a massa do hélio é 4,002. Estão faltando 0,03 u de massa, e por isso durante a formação de um núcleo de hélio, essa massa é transformada em energia. Neste caso, quando a equação de Einstein é aplicada, ocorrendo a perda de 0,03u significa que foram liberados 650 milhões de Kcal/mol de hélio.
Pode ocorrer também o defeito da massa, que é quandom a quantidade de massa é transformada em energia.
Quando prótons e nêotrons se juntam para produzir um núcleo, ocorrendo uma perda de massa que se transforma em energia, denominamos efeito de empacotamento.
http://www.colegioweb.com.br/quimica
Sabemos que é comum para alguns físicos a consideração de que a luz é como um movimento de partículas minúsculas ou como movimentação de uma onda. Por volta de 1924 Louis de Broglie propõs que o elétron poderia ser explicado como a luz, considerariamos então que um elétron em uma órbita de uma energia, iria obter um comprimento de onda particular.
Observe abaixo a expressão matemática dessa teoria:
p=h/λ, onde:
p = quantidade de movimento do elétron
λ = comprimento de onda associado
h = constante de Planck
No ano de 1927, Davisson Germer firma a teoria de Broglie. Nesta mesma época foi criado o Príncipio da Incerteza, por Wrner Heisenberg.
A quantidade de movimento e a posição de um elétron não pode ser prognosticada, ao mesmo tempo.
Não existe exatidão nas posições de um elétron, mas sim a noção de probabilidade.
Erwin Rudolf Josef Alexander Schrödinger, físico austríaco e Paul Adrien Maurice Dirac, engenheiro e matemático britânico, firmaram no mesmo período equações, na qual descrevia o movimento ondulatório do elétron. Para indicar a extensão da onda utiliza-se ψ.
Em seguida Born, conclui que ψ2, estava associado com a probabilidade de encontrar-se com os elétrons.
10. Partículas subatômicas
As partículas subatômicas refere-se a particulas minúsculas, ou seja, particulas menores que o átomo, além das esseciais, que são: prótons, nêutrons e elétrons.
Sabe-se da existência de dezenas dessas partículas, observe a tabela abaixo:

Pósitron ou elétron positivo contém sua massa igual à massa do elétron e sua carga também, porém o sinal é oposto.
As massas dos mésons são intermediárias entre as do próton e a do elétron, averigua-se que é responsável por unir prótons e nêutrons no núcleo.
Neutrinos não possuem partículas significativas de massa e sua carga elétrica é nula. Sua formação provável é: nêutron – próton + elétron + neutrino.
Quando um pósitron agrega-se a um elétron, significa que duas partículas de polaridade opostas que se relacionam, na qual a formação de energia aparece em forma de ondas. Vejamos:

A construção de equivalência entre matéria e energia, foi estabelecida por Einstein, observe:
E = m. c2
Onde:
m - massa em quilograma transformada em energia.
E - a energia em joule, produzida pela extinção da massa m.
c – velocidade da luz em metros por segundo – 3 x 108 m/s.
9 x 1013 joules, é energia necessária para levantar mil toneladas numa até uma altura de 10 km. Lembrando que 9 x 1013 se forma em 1 grama de matéria.
Recentemente conclui-se que a antimatéria, é produzida pelas antipartículas, ou seja, pelos antielétrons, pelos antiprótrons e pelos antinêutrons.
Foi possível obter o anti-hidrogenio, com isolamento e áreas magnéticas, ele foi formado por antipróton, núcleo e antielétron. Vejamos: 3

Teoria de Quarks
Quarks é um dos elementos fundamentais que formam a matéria, outro elemento fundamental é o lépton onde podemos encontrar o elétron.
Sabe-se que os quarks são seis:
1)“Up” (para cima) com carga de + 2/3, e 2)“down” (para baixo) com carga de – 1/3 constituem os prótons e os nêutrons.
Observe como é contituído o próton e o nêutrons:

- Para formar o próton há dois “up”, e um “down” .
- Para fortmar o nêutron há dois “down” e um “up”.
3) “Charm” (charme) com carga de + 2/3.
4) “Strange” (estranho) com carga de – 1/3.
Ambos são encontrados nos raios cósmicos.
5) “bottom” com carga de – 1/3.
6) “top” com carga de + 2/3, é aproximadamente 200 vezes mais pesado que um próton, por isso ele não é encontrado nos raios cómicos, nem em fenômenos naturais.
11. Estabilidade do Núcleo
Se tratando da estabilidade do núcleo, podemos dizer que o núcleo possui Z prótons a também A – Z nêutrons apertados em uma região com aproximadamente 10-12cm de raio.
Para podermos explicar essa estabilidade, devemos considerar a conversão de massa em energia. Para entendermos melhor, vamos pensar no núcleo do hélio, que é composto por 2 nêutrons e por 2 prótons. Considerando que a massa de apenas 1 próton é de 1,00732u e a massa de apenas 1 nêutron é de 1,00866u, logo se o núcleo do hélio é composto por 2 prótons e por 2 nêutrons, teremos:
2(1,00866 u) + 2(1,00732 u) = 4,03196 u
Através de algumas experiências, chegou-se a conclusão que a massa do hélio é 4,002. Estão faltando 0,03 u de massa, e por isso durante a formação de um núcleo de hélio, essa massa é transformada em energia. Neste caso, quando a equação de Einstein é aplicada, ocorrendo a perda de 0,03u significa que foram liberados 650 milhões de Kcal/mol de hélio.
Pode ocorrer também o defeito da massa, que é quandom a quantidade de massa é transformada em energia.
Quando prótons e nêotrons se juntam para produzir um núcleo, ocorrendo uma perda de massa que se transforma em energia, denominamos efeito de empacotamento.
http://www.colegioweb.com.br/quimica






Parabéns, gostei da clareza de suas colocações.
ResponderExcluir