1. Introdução
Ocorrem ligações químicas quando os átomos se unem e se ligam quimicamente, formando assim as moléculas.
Observe: H2

Essas moléculas se classificam em substâncias simples e substâncias compostas.
As substâncias simples possuem atomicidade, ou seja, elas possuem uma quantidade de átomos. Observe os exemplos abaixo:
Oxigênio (O2) – atomicidade 2
Ozone (O3) – atomicidade 3
Hélio (He) – atomicidade 1, ou seja, átomo isolado
As substâncias compostas são formadas por átomos de elementos diferentes, como por exemplo: amônia (NH3) e água (H2O).2. Regras do Octeto “Ocorrem reações químicas em que participam elementos químicos com estrutura menos estável, porque elementos químicos com estrutura eletrônica menos estável têm tendência a adquirir estrutura mais estável por meio do ganho, da perda ou do compartilhamento de elétrons.”
A camada de valência é quando o átomo está em seu último nível eletrônico, ou seja, é a última camada do átomo, e os elétrons que, pertencem a essa camada, normalmente estão presentes em alguma ligação química.
Gases que possuem 8 elétrons na camada de valência são átomos não-reativos, ou seja, muito estáveis.
Para alcançar a 8 elétrons na camada de valência, é necessário que ocorra a reação desses elétrons com outros átomos, como por exemplo, gás hélio que contém apenas 2 elétrons na camada de valência (K), para átomos com essa proximidade atômica é preciso obterem a configuração de um gás nobre(H, Li, Be, B). Com isso surgiu a Regra do Octeto, criada por Lewis e Kossel.
Porém a transferência de átomos nem sempre é possível, existem três mecanismos, no qual, o átomo pode obter estabilidade, dividindo-se em três ligações: ligação covalente, ligação iônica, ligação metálica.
3. Ligação iônica ou eletrovalente Ocorrem ligações químicas quando os átomos se unem e se ligam quimicamente, formando assim as moléculas.
Observe: H2

Essas moléculas se classificam em substâncias simples e substâncias compostas.
As substâncias simples possuem atomicidade, ou seja, elas possuem uma quantidade de átomos. Observe os exemplos abaixo:
Oxigênio (O2) – atomicidade 2
Ozone (O3) – atomicidade 3
Hélio (He) – atomicidade 1, ou seja, átomo isolado
As substâncias compostas são formadas por átomos de elementos diferentes, como por exemplo: amônia (NH3) e água (H2O).2. Regras do Octeto “Ocorrem reações químicas em que participam elementos químicos com estrutura menos estável, porque elementos químicos com estrutura eletrônica menos estável têm tendência a adquirir estrutura mais estável por meio do ganho, da perda ou do compartilhamento de elétrons.”
A camada de valência é quando o átomo está em seu último nível eletrônico, ou seja, é a última camada do átomo, e os elétrons que, pertencem a essa camada, normalmente estão presentes em alguma ligação química.
Gases que possuem 8 elétrons na camada de valência são átomos não-reativos, ou seja, muito estáveis.
Para alcançar a 8 elétrons na camada de valência, é necessário que ocorra a reação desses elétrons com outros átomos, como por exemplo, gás hélio que contém apenas 2 elétrons na camada de valência (K), para átomos com essa proximidade atômica é preciso obterem a configuração de um gás nobre(H, Li, Be, B). Com isso surgiu a Regra do Octeto, criada por Lewis e Kossel.
Porém a transferência de átomos nem sempre é possível, existem três mecanismos, no qual, o átomo pode obter estabilidade, dividindo-se em três ligações: ligação covalente, ligação iônica, ligação metálica.
Quando aparece a ligação iônica
A ligação iônica é baseada na atração eletrostática de dois íons com cargas opostas.
A ligação iônica aparece quando um átomo tem 1 a 3 elétrons na camada de valência, geralmente dos metais, esses átomos perdem elétrons, fazendo com que se transformem em cátions, sendo assim o número de elétrons ficará menor que o número de prótons.
1) Metais – São aqueles que possuem 1, 2 ou 3 elétrons na camada de valência. A tendência dos metais é perder esses elétrons.
Exemplos:
a) 19K:1s22s22p63s23p64s1
19K1+:1s22s22p63s2p6
b)20Ca:1s22s22p63s23p64s2
20Ca2+:1s22s22p63s23p6
2) Ametais – São aqueles que possuem 4, 5, 6 ou 7 elétrons na camada de valência. A tendência dos ametais é receber elétrons.
Exemplos:
a)16S:1s22s22p63s23p4
16S2–:1s22s22p63s23p6
b)9F:1s22s22p5
9F-:1s22s22p6
Apesar de estar na família 1A, o hidrogênio não é um metal, ou seja, não possui tendência de perder o seu único elétron. Na verdade, o átomo de hidrogênio tende a receber um elétron, ficando, assim, com configuração eletrônica igual à do gás nobre hélio. Como a perda de um elétron originaria um sistema sem elétrons, lembrando que o íon H+ não é estável no estado isolado.
A camada de valência dos não metais possuem mais de 4 elétrons, e são propensos a admitir elétrons. O composto é formado pela atração de íons positivos e negativos, que estão presos a atração eletrostática.
Observe:
Cloreto de potássio
Potássio: Z = 19
K | L | M | N |
2 | 8 | 8 | 1 |
Cloro: Z = 17
K | L | M |
2 | 8 | 7 |
As ligações químicas também podem ser representadas pelo diagrama de Lewis, observe abaixo:
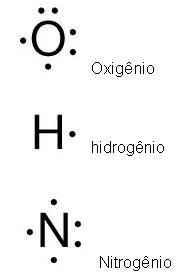
Esses pontos em volta dos símbolos são a representação dos elétrons da valência.
Observe como e possível alcançar a fórmula de um composto iônico:
O: Z = 8
K | L |
2 | 6 |
Al: Z = 13
K | L | M |
2 | 8 | 3 |
1 átomo O ganha 2 e perde 2 Al +++
1 átomo Al ganha 3 e perde 3 O--
Fórmula: Al2 O3
Portanto o diagrama de Lewis
É importante lembrar que um composto iônico é sólido e cristalino quando está em circunstâncias ambientais. Por exemplo, íons de sódio, e cloreto, ambos possuem números iguais de íons.

Cristal de cloreto de sódio, ou seja, sal comum
4. A ligação covalente
A ligação covalente acontece quando um ou mais pares de elétrons é compartilhado por átomos, fazendo com que eles se atraiam.
A ligação dativa ou coordenada acontece quando um par de elétrons é compartilhado por dois átomos, porém os dois elétrons são providos por um dos átomos.
Observe:
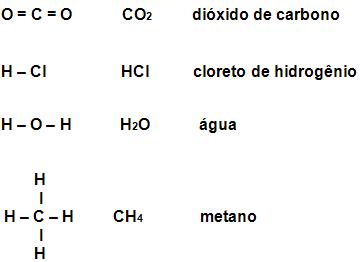
Gás sulfuroso - SO2
 Através da ilustração acima, podemos perceber que ambos (oxigênio e enxofre), possuem 6 elétrons de valência cada um. A ilustração nos mostra também que 1 átomo de enxofre se junta com um se oxigênio, através de dois pares eletrônicos simples.
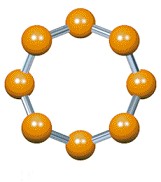
Através da ilustração acima, podemos perceber que ambos (oxigênio e enxofre), possuem 6 elétrons de valência cada um. A ilustração nos mostra também que 1 átomo de enxofre se junta com um se oxigênio, através de dois pares eletrônicos simples. Molécula de enxofre – S8
Ele é formado por um anel de oito átomos de enxofre, no qual, onde cada um realiza 2 ligações simples. Observe abaixo a molécula S8, vista de dois ângulos diferentes.
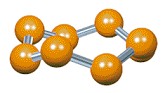
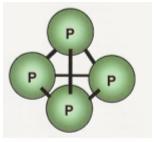
Molécula de fósforo branco – P4
Cada átomo de fósforo constitui 3 ligações simples.
Resolução da fórmula molecular do composto, a partir dos números atômicos dos elementos
Observe o exemplo abaixo:
Como seria a fórmula mais provável do composto formado a partir de um elemento A, com número atômico 7, combinado com um elemento B, com número atômico 9?
Vejamos a resolução:
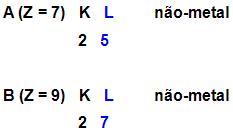
Onde:
A e B são ligações covalentes.
Para ficar com 8 elétrons na camada de valência, é necessário que A faça 3 pares eletrônicos, já o B é necessário fazer apenas 1 par eletrônico, sendo assim a fórmula ficaria assim: AB3
5. Ligação metálica
Cristais metálicos
Alguns metais apresentam em sua composição minúsculos cristais, que só é possível vê-los com um microscópio, como nos mostra a figura abaixo:
A ligação metálica
Com relação ao sólido é correto dizer que os átomos ficam bem perto um dos outros, porém organizados variadamente.
Observe a configuração eletrônica de alguns metais:
Na (Z = 11) (configuração do neônio) 3s1
Fe (Z = 26) (configuração do neônio) 3p6 4s2
Ag (Z =47) (configuração do neônio) 4p10 5s1
Podemos dizer que existe uma espécie de nuvem no retículo cristalino metálico, formada por íons positivos com ipedlink1ao redor e orbitais que passam uns pelos outros, como mostra a ilustração abaixo:
Propriedades físicas mais características dos metais - os metais são maleáveis, e são capazes de se transformar em lâminas;
- os metais são dúcteis, e são capazes de se transformar em fios;
- os metais são bons condutores de calor;
- os metais refletem quase toda a luz, pelo fato de serem opacos à luz;
- os metais possuem alta densidade.
Entre outras propriedades, e é importante lembrar que nem todas as propriedades se aplicam a todos os metais. - os metais são dúcteis, e são capazes de se transformar em fios;
- os metais são bons condutores de calor;
- os metais refletem quase toda a luz, pelo fato de serem opacos à luz;
- os metais possuem alta densidade.
Ligas metálicas
As ligas metálicas são compostas por dois ou mais metais, e pode conter também elementos não metálicos, porém a maior quantidade desses elementos deve ser metálica. Para formar uma liga é necessário fundir os metais, para que eles atinjam um estado líquido propenso para serem misturados.
Observe abaixo a composição das ligas mais comuns em nosso cotidiano.
Aço — constituído por Fe (ferro) e C (carbono).
Aço inoxidável — constituído por Fe (ferro), C (carbono), Cr (cromo) e Ni(níquel).
Ouro 18k — constituído por 75% de Au (ouro) e 25% de Ag (prata) e/ou Cobre. Já o ouro 24K é constítuido 100% de ouro.
Amálgama — constituída por Hg (mercúrio),
Bronze — constituído por Cu (cobre) e Sn (estanho).
Latão— constituído por Cu (cobre) e Zn (zinco).
7. Ligações sigma (σ) e ligações pi (π)
Superposição de orbitais (overlap)
Orbital molecular – esse orbital é composto pela interpenetração de dois orbitais atômicos, e pode-se perceber que um aponta diretamente para o outro.
Superposição de orbitais (overlap)
Orbital molecular – esse orbital é composto pela interpenetração de dois orbitais atômicos, e pode-se perceber que um aponta diretamente para o outro.
Observe a figura abaixo.
Quando um plano possui uma densidade eletrônica nula, ele é denominado plano nodal. Podemos perceber que σ não possui um plano nodal contendo um eixo internuclear. Se o orbital estiver ocupado por dois elétrons, podemos dizer que os átomos estão ligados por σ.
Vejamos o esquema de como essas ligações ocorrem:
Já π possui um plano nodal, contendo um eixo internuclear. Se o orbital π for ocupado por dois elétrons, irá resultar em uma ligação π, existente entre dois átomos.
Quando ocorre a ligação sigma, e a ligação pi?
Quando uma ligação for σ, será uma ligação simples.
Quando uma ligação for σ e a outra for π, teremos uma ligação dupla.
Quando uma ligação for σ e as outras forem π, teremos uma ligação tripla.
A molécula do nitrogênio – N2
Na molécula do nitrogênio três pares de elétrons são compartilhados entre os átomos, é o que mostra a estrutura de Lewis, já no modelo orbital, um par de elétrons é acomodado em um orbital σ e os outros dois pares são acomodados em dois orbitais π. Observe abaixo:
-os dois átomos de nitrogênio.
- as duas ligações π
Ligações químicas
7N: 1s2 2s2 2p3 (5 elétrons na camada de valência).
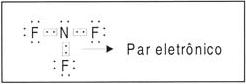
Fórmula de Lewis (eletrônica): são representados apenas os elétrons de valência.

b) 1H: 1s1
8O: 1s2 2s2 2p4
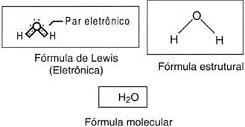
Nos exemplos, podemos notar que, na formação do par, cada átomo participa com 1 elétron. Quando o compartilhamento é feito dessa forma, dizemos que ocorreu uma ligação covalente comum. Observe agora o caso do monóxido de carbono (CO):
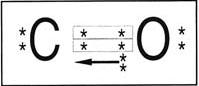
Note que há duas ligações covalentes comuns e uma outra representada por uma seta . Esse “novo” tipo de ligação é chamada de covalente coordenada ou dativa. A ligação dativa ocorre quando apenas um átomo contribui na formação do par .
Observação – A ligação dativa ocorre quando não há mais possibilidade de realização da covalente comum; então, o átomo isolado com oito elétrons na última camada, e que possui pares isolados, cede um par eletrônico para um outro átomo que precise receber dois elétrons.
Características das substâncias covalentes e moleculares.
Primeiramente, é importante diferenciar uma substância covalente de uma substância molecular.
1) Substância covalente – Sólido cristalino formado somente por ligações covalentes. Formam macromoléculas.
Exemplo: diamante C(n) e grafite C(n).
2) Substância molecular – São compostos que só apresentam ligações covalentes entre seus átomos, intramoleculares, mas não entre moléculas, intermoleculares.
Exemplo: H2O, H2SO4 e NO2
Propriedades dos compostos covalentes ou moleculares – Um composto é molecular quando sua estrutura apresentar apenas ligações covalentes.
– Não possuem íons; possuem moléculas.
– Baixa condução de corrente elétrica (exceto grafite) quando puras. No entanto, quando em solução aquosa, se houver formação de íons (ionização), passam a conduzir corrente elétrica.
– Podem ser sólidos, líquidos ou gasosos.
– Apresentam baixas temperaturas de fusão e de ebulição (não resistem ao calor).
– Geralmente, são insolúveis em água. A solubilidade em água vai depender da polaridade da molécula.
OSERVAÇÃO:
Assim sendo, os átomos podem formar ligações por métodos diversos.
Tipos de Ligação Ligação Iônica ou Eletrovalente – é o tipo de ligação que ocorre entre metal e ametal (ou hidrogênio). Na ligação iônica, teremos transferência definitiva de elétrons, originando cátions e ânions, que sofrem atração eletrostática formando uma substância sólida em condições ambientes (25°C e 1atm). Não existem moléculas nos sólidos iônicos. O que eles apresentam é um conjunto de íons bem organizados, em proporção definida, denominado retículo cristalino.
Tipos de Ligação Ligação Iônica ou Eletrovalente – é o tipo de ligação que ocorre entre metal e ametal (ou hidrogênio). Na ligação iônica, teremos transferência definitiva de elétrons, originando cátions e ânions, que sofrem atração eletrostática formando uma substância sólida em condições ambientes (25°C e 1atm). Não existem moléculas nos sólidos iônicos. O que eles apresentam é um conjunto de íons bem organizados, em proporção definida, denominado retículo cristalino.
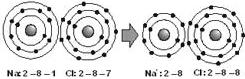
Cloreto de Sódio
Sejam as configurações eletrônicas do 11Na e 17Cl
Na: 2 - 8 - 1 Cl: 2 - 8 - 7
Para estabilizar o Na é melhor ganhar 7 elétron ou perder 1 elétron ? Será mais conveniente perder 1 elétron.
Para o Cl será melhor ganhar 1 elétron.
Sendo assim o sódio ficará com a configuração do 10Ne e o Cl com a do 18Ar .
Quando o n.° de elétron é menor que o de prótons o composto é um cátion, mas quando o n.° de elétron é maior do que o de prótons o composto é um ânion.
Na ligação iônica, teremos sempre transferência de elétrons.
Utilizando o método de Lewis, no qual é representado o último nível eletrônico do átomo ou camada de valência por pontos.

Fórmula eletrônica ou de Lewis:
Propriedades dos compostos iônicos – Um composto é iônico quando apresenta em sua estrutura pelo menos uma ligação iônica, pode ter ligações covalentes.
– São sólidos cristalinos.
– Geralmente são solúveis em água, e a solução resultante conduz corrente elétrica.
– Possuem altas temperaturas de fusão e de ebulição (portanto, resistem ao calor). Por exemplo, o cloreto de sódio tem TF = 800°C e TE = 1400°C.
Ligação Covalente – A ligação covalente ocorre quando há compartilhamento ordenado de pares de elétrons entre os átomos envolvidos. Tal compartilhamento, geralmente, ocorre entre os ametais ou entre esses e o hidrogênio. Observando os exemplos abaixo, podemos notar como o processo ocorre.
a) 9F: 1s2 2s2 2p5 (7 elétrons na camada de valência).
LIGAÇÕES QUÍMICAS -2
7. Ligação covalente polar
Ligação covalente polar, é quando os átomos que estão ligados apresentam eletronegatividades variadas.
Por exemplo: AB, sendo B mais eletronegativo, logo ele possui mais densidade eletrônica, desta forma podemos considerar B como um pólo negativo, consequentemente, A será positivo, portanto podemos considera-lós um dipolo elétrico, por conter uma partícula com dois pólos.
Como não ocorreu uma separação completa das cargas, podemos dizer que a carga do pólo não é considerada a carga de um elétron, portanto ela é considerada uma fração da carga do elétron.
Considerando:
q como a carga;
d como a distância que separa essas cargas.
μ = q. d
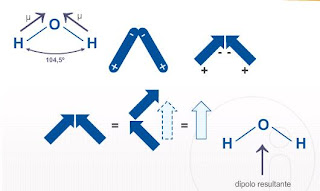
Um ventor é comumente normalmente é relacionado à convenção abaixo, observe:
Ocorre que, os núcleos do oxigênio afastam os prótons, formando uma estrutura molecular carregada positivamente, isso ocorre próximo aos núcleos de hidrogênio que estão carregados negativamente, que por sua vez se encontram próximos aos orbitais do oxigênio que não foram compartilhados.
Molécula polar: quando μ total ≠ 0, sendo esta molécula eletricamente assimétrica, ou seja, cada carga (positiva e negativa) possui o seu centro.
Molécula não-polar: quando μ total = 0, sendo esta uma molécula eletricamente simétrica, ou seja, possui os centros de cargas (positivo e negativo) simultâneos. Vejamos uma consideração muito importante:
μ total: é considerada a soma vetorial dos instantes dipolares, que estão presentes entre os átomos que compõe a molécula.
Por exemplo: CO2 (gás carbônico)
Esta molécula é linear, geometricamente simétrica desta forma ela é não-polar, mesmo contendo duas ligações polares.
Observe esses exemplos:
a) Metano e Tetracloreto de Carbono possuem:
- molécula não-polar;
- simetria tetraédrica;
- os quatro vetores μ, resultam em um valor nulo.
Apolar
A molécula é apolar quando os quatro ligantes forem idênticos.
Por exemplo: CCl4, CH4
Polar
A molécula é polar quando os quatro não forem diferentes um dos outros.
Por exemplo: CH3Cl, CH2Cl2
- BeF2(gasoso) – molécula não-polar.
As forças de atração existentes entre as moléculas são:
a) atração gravitacional, as massas das moléculas individuais são minúsculas, por isso, descossideraremos essa atração.
b) forças de Van Waals
b1) força entre dipolos permanentes (F.D.P)
b2) força entre dipolos induzidos (força de London)
c) ponte de hidrogênio.
Forças entre dipolos permanentes (F.D.P)
Essa força está presente entre moleculas polares (μ ≠ 0), contêm dipolo permanente, a força varia de acordo com o seu tamanho e quanto maior ele for, maior a força será.
Por exemplo: acetonitrilo (etanonitrilo), neste caso a extremidade positiva de uma molécula atrai a negativa de uma outra molécula.
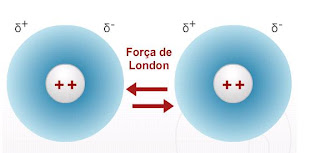
Forças entre dipolos induzidos ‘(Força de London)
Essa força está relacionada a força de atração existente entre as extremidades positivas e negativas dos dipolos.
Essa força pode acontecer, por exemplo, no hélio liquido, no CO2 e no metano.
Os átomos de hélio estão simétricos, em um espaço de tempo mais longo, portanto podemos concluir que os elétrons estão localizados simetricamente em torno do núcleo. Observe a figura.
Subitamente, ocorre uma colisão que resulta em um distanciamento entre os elétrons e o núcleo, desfazendo a simetria, o que resulta em uma pequena atração do átomo.
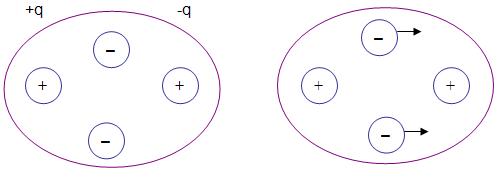
Ponto de hidrogênio
A ponte de hidrogênio é uma força intermolecular extremamente alta, que ocorre pela interação dipolo-dipolo, essa ponte serve como um tipo de “elo” entre os átomos que se interaram.
Para a formação da ponte de hidrogênio é preciso que ocorra com elementos muito eletronegativos (F,O,N), e além disso esses elementos devem possuir pares eletrônicos não- compartilhados e também um átomo de hidrogênio que esteja ligado ao átomo.
Desta forma, essa ponte aparece em alguns compostos, observe abaixo:
A ponte é constituida por um átomo de hidrogênio de uma molécula que interage com um par de elétrons de outra molécula.
É possível visualizar as pontes de hidrogênio, mesmo no estado de vapor do fluoreto de hidrogênio, pelo fato de serem bem fortes.
10. Ponto de ebuliçãoSabemos que a distância entre as partículas que compõe a substância é um dos fatores que difere os três estados de agregação.
Para ampliar a distância entre as partículas, deve-se ferver um líquido bem consistente, pois será preciso dar energia para vencer as força intermoleculares.
A dificuldade para separar as moléculas aumenta de acordo com o aumento da força F e do ponto de ebulição.
Forças de London
O ponto de ebulição é de acordo com a força, ou seja, quando maior a força, maior o ponto de ebulição.
Quanto maior a massa molecular, maior será a chance de ocorrer uma polarização instantânea.
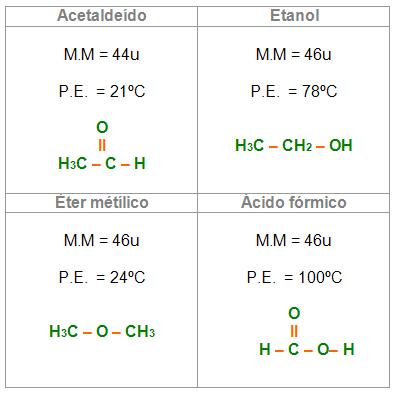
etano –– C2H6: P.E. = -88ºC –– M. M = 30u
metano –– CH4: P.E. = -161º –– M. M. = 16u
Entre as moléculas de massa molecular alta, estão presentes as forças de London também altas. Por esse fato, hidrocarbonetos que possuem 40 ou mais átomos de carbono não poderam ser vaporizados, pois antes de alcançar o ponto de ebulição os compostos iriam se decompor.
O ponto de ebulição dos compostos de cadeia ramificada é mais baixo que seu isômero de cadeia reta. É importante lembrarmos que essa ramificação faz com que a superficie fique menor, fazendo com que as forças de London fiquem mais fracas.
Vejamos:
Mesmo apresentando números de átomos iguais, as propriedades dos isômeros n-pentano e neopentano não são iguais, logo, as propriedades são diferentes.
Interações dipolo-dipolo (F.D.P.)
Quanto maior o momento dipolar, maior será o ponto de ebulição do mesmo.
Por exemplo:
C3H8 – propano (μ ≡ 0) P.E. = 42ºC
CH3CN – acetonitrilo (polar, μ ≠ 0) P.E = 81,6ºC
Ponte de hidrogênio
O ponto de ebulição nos compostos que possuem ponte de hidrogênio anormalmente é maior.
Pelo fato de que as pontes de hidrogênio da água ser mais resistente o ponto de ebulição é maior, percebemos então que o ponto de ebulição dos álcoois apresentando até 3C são menores, do que o ponto de ebulição da água.
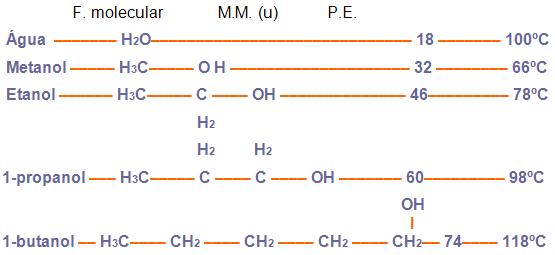
Os compostos que possuem ponto de ebulição maior do que estes acima são os que apresentam ponte de hidrogênio em relação aos que não possuem ponte de hidrogênio de massa molecular que se compara. Vejamos alguns exemplos:
11. Solubilidade
Para falarmos de solubilidade, devemos lembrar que a dissolução é considerado um processo físico-quimico, e sempre dependendo de todas as forças de coesão que ligam todas as partículas do soluto, todas as moléculas do solvente.
Mesmo não dando para saber quando uma substância é solúvel a outra, podemos dizer que essa dissolução irá ocorrer com muita facilidade quando todas as forças de ligação existentes entre as moléculas do solvente de certo lado, e existentes entre as partículas do soluto do outro lado, apresentarem o mesmo tipo e a mesma magnitude.
A substância será solúvel a outra, quando elas forem parecidas. Para sabermos onde há essa semelhança, devemos observar sua estrutura, sua polaridade e seu caráter de forças moleculares. Portanto como um exemplo, podemos dizer que qualquer composto polar é totalmente solúvel em um solvente polar.
Vejamos um exemplo:
HCl, NH3, H2SO4 – solúveis em H2O.
Desta forma conclui-se que composto não-polar pode ser totalmente solúvel em solvente não-polar.
Vejamos um exemplo:
I2 – benzeno, soluveis em CCl4.
Para falarmos de solubilidade, devemos lembrar que a dissolução é considerado um processo físico-quimico, e sempre dependendo de todas as forças de coesão que ligam todas as partículas do soluto, todas as moléculas do solvente.
Mesmo não dando para saber quando uma substância é solúvel a outra, podemos dizer que essa dissolução irá ocorrer com muita facilidade quando todas as forças de ligação existentes entre as moléculas do solvente de certo lado, e existentes entre as partículas do soluto do outro lado, apresentarem o mesmo tipo e a mesma magnitude.
A substância será solúvel a outra, quando elas forem parecidas. Para sabermos onde há essa semelhança, devemos observar sua estrutura, sua polaridade e seu caráter de forças moleculares. Portanto como um exemplo, podemos dizer que qualquer composto polar é totalmente solúvel em um solvente polar.
Vejamos um exemplo:
HCl, NH3, H2SO4 – solúveis em H2O.
Desta forma conclui-se que composto não-polar pode ser totalmente solúvel em solvente não-polar.
Vejamos um exemplo:
I2 – benzeno, soluveis em CCl4.
8. Propriedades dos compostos moleculares
Ponto de fusão e ponto de ebulição baixos
Em moléculas gigantes e macromoléculas, o ponto de fusão(P.F) e o ponto de ebulição(P.E), são muito altos, predominando assim o estado líquido.
São insolúveis em água os compostos moleculares não-polares, já os polares são solúveis em água.
Para conduzir corrente elétrica é necessário que os compostos moleculares estejam dissolvidos em água.
Por exemplo:
Ponto de fusão e ponto de ebulição baixos
Em moléculas gigantes e macromoléculas, o ponto de fusão(P.F) e o ponto de ebulição(P.E), são muito altos, predominando assim o estado líquido.
São insolúveis em água os compostos moleculares não-polares, já os polares são solúveis em água.
Para conduzir corrente elétrica é necessário que os compostos moleculares estejam dissolvidos em água.
Por exemplo:
12. Propriedades dos compostos iônicos
Compostos iônicos, são sólidos cristalinos, que não formam moléculas, portanto podemos dizer que eles formam associações compactas de íons.
Apresentam elevado ponto de fusão e ponto de ebulição
Por exemplo:
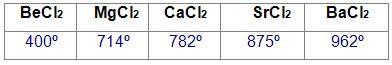
Ponto de fusão – Cloretos dos metais alcalinoterrosos.
Ponto de ebulição – NaCl : 1465º
No estado sólido não conduzem eletricidade
Neste estado eles ficam presos e conduzem eletricidade tanto em solução aquosa como no estado fundido, portanto após isso os íons são totalmente libertados.
Dissolvem-se em água formando soluções iônicas
A lei de Coulomb é que determina ,através da fórmula, a força de atração entre dois íons.

- q+ q- são cargas separadas pela distância r.
- ﻉ é a constante dielétrica, e está entre as duas cargas.
Compostos iônicos, são sólidos cristalinos, que não formam moléculas, portanto podemos dizer que eles formam associações compactas de íons.
Apresentam elevado ponto de fusão e ponto de ebulição
Por exemplo:
Ponto de fusão – Cloretos dos metais alcalinoterrosos.

Ponto de ebulição – NaCl : 1465º
No estado sólido não conduzem eletricidade
Neste estado eles ficam presos e conduzem eletricidade tanto em solução aquosa como no estado fundido, portanto após isso os íons são totalmente libertados.
Dissolvem-se em água formando soluções iônicas
A lei de Coulomb é que determina ,através da fórmula, a força de atração entre dois íons.

- q+ q- são cargas separadas pela distância r.
- ﻉ é a constante dielétrica, e está entre as duas cargas.
Teoria da repulsão dos pares de elétrons da camada de valência (teoria RPECV)
Introdução:
Segunda a teoria da repulsão dos pares de elétrons da camada de valência, a disposição dos átomos no espaço ao redor do átomo central, é dada a partir da repulsão existente entre os pares de elétrons que ficam na camada de valência do átomo central.
Desta forma os pares de elétrons se localizam o mais afastado possível, uns dos outros, para evitar uma repulsão brusca.
Observe abaixo, como estão organizados os pares de elétrons ao redor de um determinado átomo:
Dois pares de elétrons, linear.
Introdução:
Segunda a teoria da repulsão dos pares de elétrons da camada de valência, a disposição dos átomos no espaço ao redor do átomo central, é dada a partir da repulsão existente entre os pares de elétrons que ficam na camada de valência do átomo central.
Desta forma os pares de elétrons se localizam o mais afastado possível, uns dos outros, para evitar uma repulsão brusca.
Observe abaixo, como estão organizados os pares de elétrons ao redor de um determinado átomo:
Dois pares de elétrons, linear.
Os núcleos dos átomos são responsáveis pelo formato das moléculas.
Moléculas lineares
Para que a molécula seja linear, ela irá depender do tipo do átomo central (A).Observe os tipos abaixo:
Para que ocorra menor repulsão entre os pares de elétrons, eles devem estar localizados nos lados opostos do núcleo, isso vale também para as duplas e para as tripas ligações, segundo a teoria RPECV.
Por exemplo:
Moléculas planas triangulares

Moléculas tetraédricas




























Nenhum comentário:
Postar um comentário