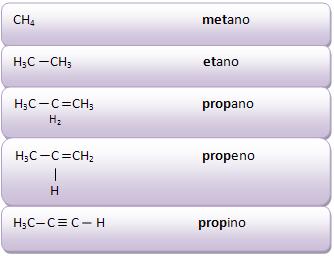
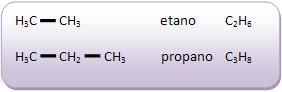
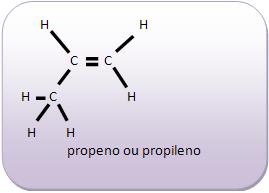
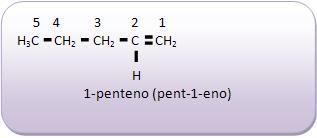
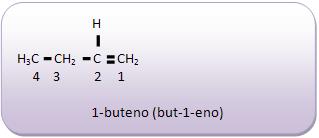
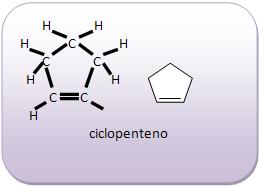
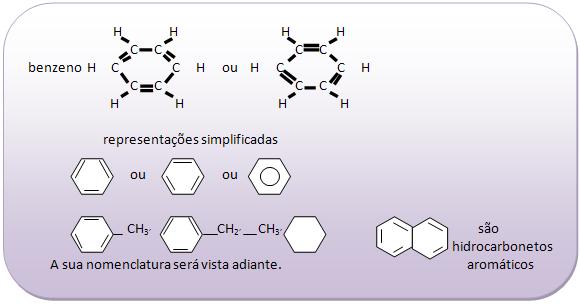
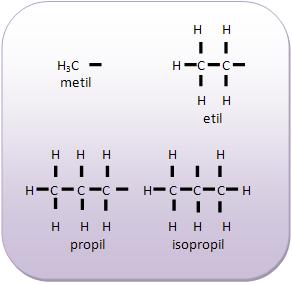
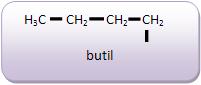
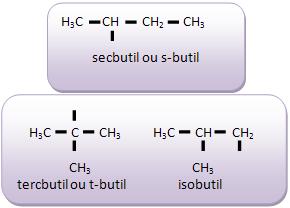
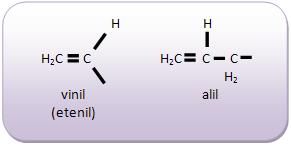
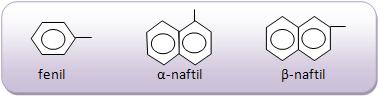
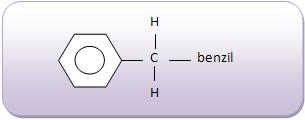
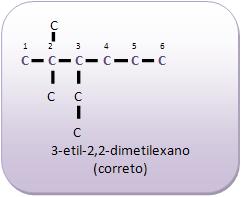
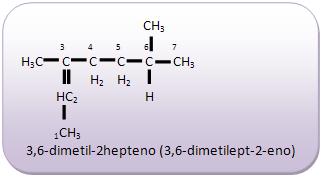
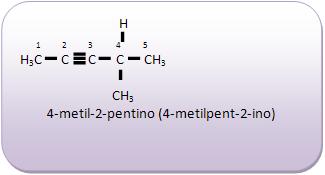
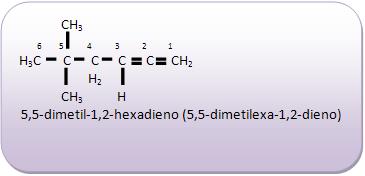
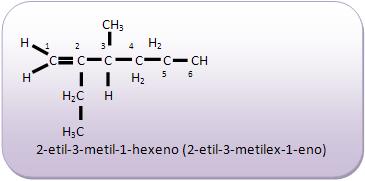
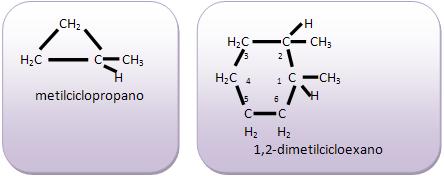
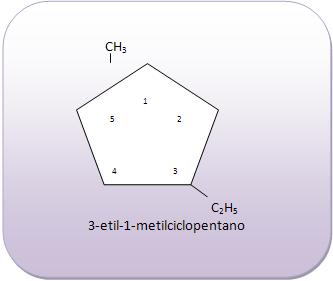
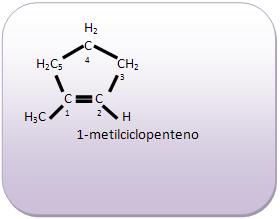
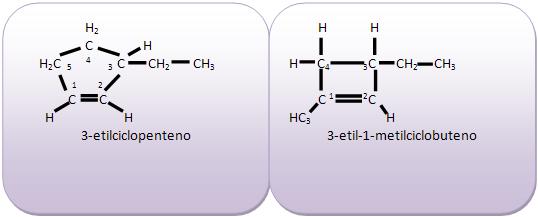
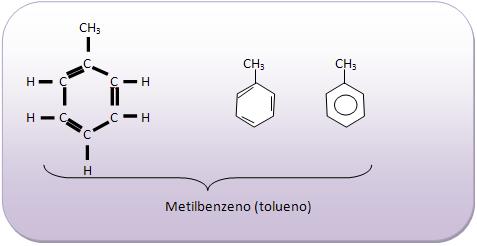
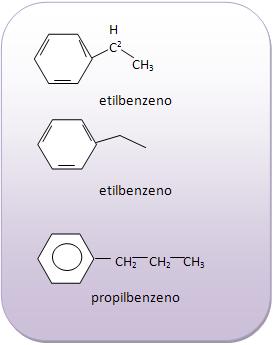
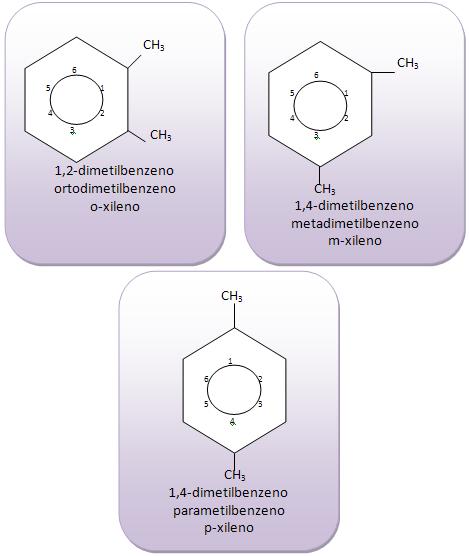
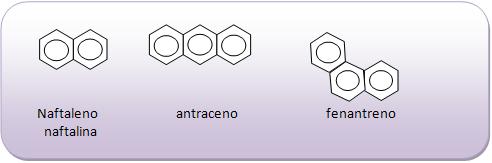
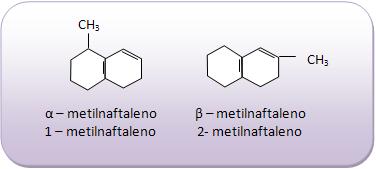
Introdução à Química Orgânica
BERZELIUS
"Somente os seres vivos podem transformar substâncias minerais em orgânicas." (Teoria da Força Vital)
WHÖLLER
Síntese da uréia (composto orgânico) a partir do cianato de amônio" (composto inorgânico) em laboratório.
Características do carbono
Postulados de Kekulé:
a) É tetracovalente.
b) Os ângulos entre as valências são de 109º 28’, adquirindo a forma de um tetraedro regular.
c) Possui a propriedade de encadeamento.
d) Um átomo de carbono pode formar uma, duas ou até três ligações com um segundo átomo, realizando, assim, respectivamente, ligações simples, duplas ou triplas.
Assim, classificamos as ligações do carbono em:
a) Sigma (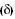 ) – É a primeira ligação entre dois átomos. Ocorre, neste caso, uma superposição de orbitais (overlap).
) – É a primeira ligação entre dois átomos. Ocorre, neste caso, uma superposição de orbitais (overlap).
b) Pi (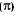 ) – São as segundas e terceiras ligações entre dois átomos. Agora, o que ocorre é uma aproximação entre os orbitais.
) – São as segundas e terceiras ligações entre dois átomos. Agora, o que ocorre é uma aproximação entre os orbitais.
Número de átomos de C unidos diretamente a ele:
• Carbono primário.
• Carbono secundário.
• Carbono terciário.
• Carbono quaternário.
Saturação
SATURADO: é aquele que apresenta apenas simples ligações;
C — C — C — C
INSATURADO: aquele que apresenta dupla ou tripla ligação:
C = C - C - C ou C º C C - C
C - C
Hibridização do Carbono
1. sp3 (tetraédrica)
a) é a fusão de quatro orbitais (um do tipo s e três do tipo p) formando quatro orbitais do tipo sp3;
b) forma somente ligações simples;
c) ângulo entre as valências: 109º 28’;
d) é característica dos alcanos;
e) carbono liga-se a outros quatro átomos.
2. sp2 (trigonal)
a) é a fusão de um orbital s com dois orbitais p, formando três orbitais do tipo sp2;
b) forma duas ligações simples e uma dupla;
c) ângulo entre as valências: 120º;
d) é característica dos alcenos;
e) carbono liga-se a outros três átomos.
3. sp (linear)
a) é a fusão de um orbital s com um p formando dois orbitais do tipo sp;
b) pode formar duas ligações duplas ou uma tripla e uma simples;
c) ângulo entre as valências: 180º;
d) é característica dos alcinos e alcadienos;
e) carbono liga-se a outros dois átomos.
2- Ocorrência e obtenção de compostos orgânicos
Para obter a maioria dos comportos orgânicos, hoje podemos prapará-los por síntese, mas a maneira mais fácil de se obter é isolá-los a partir de produtos animais e vegetais.
Os combustíveis fósseis, que são considerados fontes de energia não-renováveis, são extraídos do petróleo, do carvão e do gás natural. Esses combustíveis se formaram com as transformações de animais e plantas que ocorreram na crosta terrestre a milhões de anos.
Na biomassa são encontrados também outros depósitos de materiais orgânicos, podendo durar na Terra, se for usada com cuidado.
As plantas torna sintéticos muitos compostos orgânicos como as essências, os perfumes, a celulose, a cânfora, a morfina e os ingredientes para pintura.
Os três principais constituintes dos alimetos são: hidratos de carbono encontrados nos açúcares solúveis em água, os lipídeos são óleos e gorduras encontrados nos animais e vegetais, como azeite de oliva, oléo de milho, óleo de baleia, óleo de fígado de bacalhau, sebo e gordura de coco, e as proteínas podem ser encontradas tanto nos animais como nos vegetais, como enzimas, colágeno, fibrina, insulina, queratina, hemoglobina.
BERZELIUS
"Somente os seres vivos podem transformar substâncias minerais em orgânicas." (Teoria da Força Vital)
WHÖLLER
Síntese da uréia (composto orgânico) a partir do cianato de amônio" (composto inorgânico) em laboratório.
Características do carbono
Postulados de Kekulé:
a) É tetracovalente.
b) Os ângulos entre as valências são de 109º 28’, adquirindo a forma de um tetraedro regular.
c) Possui a propriedade de encadeamento.
d) Um átomo de carbono pode formar uma, duas ou até três ligações com um segundo átomo, realizando, assim, respectivamente, ligações simples, duplas ou triplas.
Assim, classificamos as ligações do carbono em:
a) Sigma (
b) Pi (
Número de átomos de C unidos diretamente a ele:
• Carbono primário.
• Carbono secundário.
• Carbono terciário.
• Carbono quaternário.
Saturação
SATURADO: é aquele que apresenta apenas simples ligações;
C — C — C — C
INSATURADO: aquele que apresenta dupla ou tripla ligação:
C = C - C - C ou C º C
Hibridização do Carbono
1. sp3 (tetraédrica)
a) é a fusão de quatro orbitais (um do tipo s e três do tipo p) formando quatro orbitais do tipo sp3;
b) forma somente ligações simples;
c) ângulo entre as valências: 109º 28’;
d) é característica dos alcanos;
e) carbono liga-se a outros quatro átomos.
2. sp2 (trigonal)
a) é a fusão de um orbital s com dois orbitais p, formando três orbitais do tipo sp2;
b) forma duas ligações simples e uma dupla;
c) ângulo entre as valências: 120º;
d) é característica dos alcenos;
e) carbono liga-se a outros três átomos.
3. sp (linear)
a) é a fusão de um orbital s com um p formando dois orbitais do tipo sp;
b) pode formar duas ligações duplas ou uma tripla e uma simples;
c) ângulo entre as valências: 180º;
d) é característica dos alcinos e alcadienos;
e) carbono liga-se a outros dois átomos.
2- Ocorrência e obtenção de compostos orgânicos
Para obter a maioria dos comportos orgânicos, hoje podemos prapará-los por síntese, mas a maneira mais fácil de se obter é isolá-los a partir de produtos animais e vegetais.
Os combustíveis fósseis, que são considerados fontes de energia não-renováveis, são extraídos do petróleo, do carvão e do gás natural. Esses combustíveis se formaram com as transformações de animais e plantas que ocorreram na crosta terrestre a milhões de anos.
Na biomassa são encontrados também outros depósitos de materiais orgânicos, podendo durar na Terra, se for usada com cuidado.
As plantas torna sintéticos muitos compostos orgânicos como as essências, os perfumes, a celulose, a cânfora, a morfina e os ingredientes para pintura.
Os três principais constituintes dos alimetos são: hidratos de carbono encontrados nos açúcares solúveis em água, os lipídeos são óleos e gorduras encontrados nos animais e vegetais, como azeite de oliva, oléo de milho, óleo de baleia, óleo de fígado de bacalhau, sebo e gordura de coco, e as proteínas podem ser encontradas tanto nos animais como nos vegetais, como enzimas, colágeno, fibrina, insulina, queratina, hemoglobina.
3- Importância da Química Orgânica
A Química Orgânica estuda os compostos que possuem carbono. Atualmente aproximadamente dez milhões são os compostos existentes, mas cerca de nove milhões são de compostos orgânicos.
Uma molécula orgânica complexa pode se quebrar, pois seus átomos adquirirem novas disposições, por um grande número de processos. Há também outros métodos para adicionarem a essa molécula mais átomos ou substituir seus átomos por outros átomos. A Química Orgânica resume-se em identificar essas reações, como elas se realizam e as suas possíveis aplicações na síntese de compostos.
A Química Orgânica é um estudo fundamental para a Biologia e para a Medicina. A Bioquímica estuda as moléculas e suas reações químicas, nos fundamentos da vida. Os processos biológicos análisados pela Química Orgânica, pois ao excluírem a água, os organismos vivos são formados principalmente pelos compostos orgânicos e as moléculas da Biologia Molecular são consideradas moléculas orgânicas.
A Química Orgânica estuda os compostos que possuem carbono. Atualmente aproximadamente dez milhões são os compostos existentes, mas cerca de nove milhões são de compostos orgânicos.
Uma molécula orgânica complexa pode se quebrar, pois seus átomos adquirirem novas disposições, por um grande número de processos. Há também outros métodos para adicionarem a essa molécula mais átomos ou substituir seus átomos por outros átomos. A Química Orgânica resume-se em identificar essas reações, como elas se realizam e as suas possíveis aplicações na síntese de compostos.
A Química Orgânica é um estudo fundamental para a Biologia e para a Medicina. A Bioquímica estuda as moléculas e suas reações químicas, nos fundamentos da vida. Os processos biológicos análisados pela Química Orgânica, pois ao excluírem a água, os organismos vivos são formados principalmente pelos compostos orgânicos e as moléculas da Biologia Molecular são consideradas moléculas orgânicas.
4- Os elementos formadores de compostos orgânicos
Existem milhões de compostos orgânicos, porém esses compostos são formados por poucos elementos. Os elementos organógenos são carbono, oxigênio, hidrogênio e nitrogênio (CHON), aparecendo com menor freqüência: enxofre, cloro, fósforo, iodo, bromo.
O carbono ocorre na atmosfera na forma de CO 2 (0,04% em volume). Considerado como o 17° elemento mais abundante em massa na crosta terrestre. Encontrado na forma nativa, como grafita e diamante ou se combinado com outros elementos, como petróleo, carvão, rochas do tipo carbonatos.
O elemento que mais forma compostos é o hidrogênio, sendo considerado o mais abundante do universo (92%), onde apareceu em 10º lugar na crosta terrestre.
• Carbono (número atômico: 6)
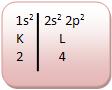
O carbono para obter a configuração de gás nobre, precisa juntar os seus quatros elétrons da camada de valência e se transformar em oito elétrons da camada de valência.
Se o átomo de carbono junta-se a quatro átomos de hidrogênio para se transformar na molécula do metano, pois carbono é tetravalente.
• Hidrogênio (Número atômico: 1)
O hidrogênio é monovalente, com um par de elétrons, ficando assim com a configuração do gás hélio.
• Oxigênio (Número atômico: 8)
O oxigênio é biovalente, estabele dois pares de elétrons.
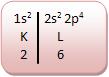
• Nitrogênio (Número atômico: 7)
O nitrogênio é trivalente, estabelece três pares de elétrons.
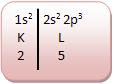
• Enxofre (Número atômico: 16)
O enxofre é bivalente.

• Fósforo (Número atômico: 15)
O fósforo é trivalente.
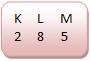
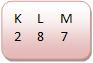
• Halogênios
Os halogênos apresentam sete elétrons em sua camada de valência.
Os halogênios são monovalentes.
• Cloro (Número atômico: 17)
5- Características dos compostos orgânicos
As leis da Química valem tanto para a compostos orgânicos quanto para inorgânicos, afirmando que são inesistentes as bases científicas para a divisão da Química orgânica ou a Química Inorgânica.
Vejamos algumas características dos compostos orgânicos:
• Elevada quantidade de compostos orgânicos.
São conhecidos cerca de 9 000 000 de compostos orgânicos. E os compostos inorgânicos são aproximadamente 1 000 000.
• Pequena quantidade de elementos constituintes.
Os elementos da estrutura dos compostos orgânicos são C, H, O, N, estes são chamados de elementos organógenos. Também aparecem mas com menor freqüência o: S,Cl, P, Mg.
• Predominância da ligação covalente.
Podemos considerar que a grande maioria dos compostos orgânicos são moleculares, pois a sua ligação é covalente com compartilhamentos de elétrons. Podendo ser formados pelas combinações de C, H, O e N (elementos não-metálicos), essa ligação entre eles será covalente. Os compostos inorgânicos são formados pela combinação de metal com não-metal, portanto a ligação entre eles será iônica.
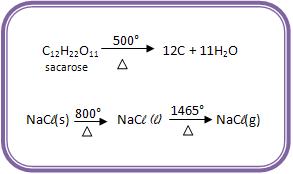
• Pequena estabilidade ao calor.
A maioria dos compostos orgânicos decompõe-se acima de 400°C. Na Química Inorgânica é comum encontrar-se compostos que não se decompõe até a temperatura de 1 000°C, como no exemplo:
A estabilidade térmica do açúcar comum (sacarose) e do sal comum (cloreto de sódio).
• Inflamabilidade
Os compostos orgânicos são combustíveis, se juntam com o gás oxigênio formando gás carbônico e água.
Para diferenciar um composto orgânico de um composto inorgânico é necessário realizar a combustão de álcool etílico, etanol o álcool comum, a diferença estará na que houver a formação do gás carbônico.

• Solubilidade em água
Existem compostos orgânicos que não são solúveis em água, como os hidrocarbonetos que compõem a gasolina. Mas também existem compostos orgânicos assim como o álcool comum, o acetato de sódio (sal orgânico) e a acetona que são soluveis a água.
• Condutividade elétrica da solução aquosa
Os compostos orgânicos em sua grande maioria são moleculares e não ionizam quando dissolvidos em água. A solução aquosa desses compostos não conduz a eletricidade. O ácido acético (ácido orgânico), o acetato de sódio (sal orgânico), quando dissolvidos em água, conduzem a corrente elétrica.
As leis da Química valem tanto para a compostos orgânicos quanto para inorgânicos, afirmando que são inesistentes as bases científicas para a divisão da Química orgânica ou a Química Inorgânica.
Vejamos algumas características dos compostos orgânicos:
• Elevada quantidade de compostos orgânicos.
São conhecidos cerca de 9 000 000 de compostos orgânicos. E os compostos inorgânicos são aproximadamente 1 000 000.
• Pequena quantidade de elementos constituintes.
Os elementos da estrutura dos compostos orgânicos são C, H, O, N, estes são chamados de elementos organógenos. Também aparecem mas com menor freqüência o: S,Cl, P, Mg.
• Predominância da ligação covalente.
Podemos considerar que a grande maioria dos compostos orgânicos são moleculares, pois a sua ligação é covalente com compartilhamentos de elétrons. Podendo ser formados pelas combinações de C, H, O e N (elementos não-metálicos), essa ligação entre eles será covalente. Os compostos inorgânicos são formados pela combinação de metal com não-metal, portanto a ligação entre eles será iônica.
• Pequena estabilidade ao calor.
A maioria dos compostos orgânicos decompõe-se acima de 400°C. Na Química Inorgânica é comum encontrar-se compostos que não se decompõe até a temperatura de 1 000°C, como no exemplo:
A estabilidade térmica do açúcar comum (sacarose) e do sal comum (cloreto de sódio).

• Inflamabilidade
Os compostos orgânicos são combustíveis, se juntam com o gás oxigênio formando gás carbônico e água.
Para diferenciar um composto orgânico de um composto inorgânico é necessário realizar a combustão de álcool etílico, etanol o álcool comum, a diferença estará na que houver a formação do gás carbônico.
• Solubilidade em água
Existem compostos orgânicos que não são solúveis em água, como os hidrocarbonetos que compõem a gasolina. Mas também existem compostos orgânicos assim como o álcool comum, o acetato de sódio (sal orgânico) e a acetona que são soluveis a água.
• Condutividade elétrica da solução aquosa
Os compostos orgânicos em sua grande maioria são moleculares e não ionizam quando dissolvidos em água. A solução aquosa desses compostos não conduz a eletricidade. O ácido acético (ácido orgânico), o acetato de sódio (sal orgânico), quando dissolvidos em água, conduzem a corrente elétrica.
6- Teoria estrutural de Kekulé
Kekulé foi um grande químico e professor que elaborou a teoria estrutural que se baseia em quatro princípios ou postulados gerais.
• Tetravalência constante
O átomo de carbono é tetravalente, ligando-se a quatro átomos monovalentes.

Friedrich August Kekulé (1829-1896), o fundador da Química Orgânica.
• As quatro valências são equevalentes
O carbono apresenta quatro valências equivalentes, por um composto com a fórmula CH 3 Cl, denominado de monoclorometano ou cloreto de metila. Se as quatro valências não fossem equivalentes, haveria quatro compostos com a fórmula CH 3 Cl.
• Encadeamento
Os átomos de carbono se ligam entre si formando as cadeias. Estas cadeias são variaveis e de todos os tipos. Ainda existem cadeias não tão longas e tão variadas como as do elemento carbono.
• Ligações entre os átomos de carbono
Se tratando dos átomos de carbono, podemos dizer que eles podem se ligar através de uma, duas ou três valências.
• Ligação Simples
Na ligação simples, dois átomos de carbono, são capazes de se ligar por meio de uma unidade de valência. A representação simbólica se dá através de um traço simples.
• Ligação dupla
Na ligação dupla, dois átomos de carbono são capazes de se ligar por meio de duas unidades de valência. A representação simbólica se dá através de dois traços.
• Ligação tripla
Na ligação tripla, dois átomos de carbono, são capazes de de se ligar por meio de três unidades de valência. A representação simbólica se dá através de três tracinhos.
7- Classificação dos átomos de carbono
Os átomos podem ser classificados conforme a sua posição na cadeia:
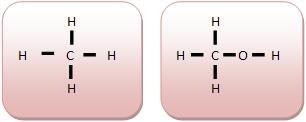
• Carbono primário
Um átomo que liga-se a um outro átomo de carbono. Os átomos de carbonos situados nas extremidades da cadeia tornam-se primários.
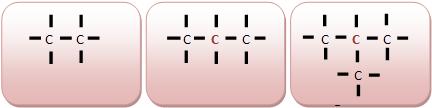
Modo primário acontece quando na molécula existe apenas um átomo de carbono.
• Carbono secundário
Um átomo que liga-se a dois outros átomos de carbono.

• Carbono terciário
Um átomo que liga-se a três outros átomos de carbono.
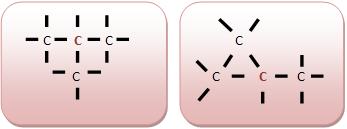
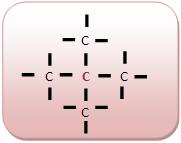
• Carbono quaternário
Um átomo que liga-se a quatro outros átomos de carbono.
Os átomos podem ser classificados conforme a sua posição na cadeia:
• Carbono primário
Um átomo que liga-se a um outro átomo de carbono. Os átomos de carbonos situados nas extremidades da cadeia tornam-se primários.

Modo primário acontece quando na molécula existe apenas um átomo de carbono.

• Carbono secundário
Um átomo que liga-se a dois outros átomos de carbono.

• Carbono terciário
Um átomo que liga-se a três outros átomos de carbono.

• Carbono quaternário
Um átomo que liga-se a quatro outros átomos de carbono.

8- Por que o número de compostos orgânicos é enorme?
Devido à alguns fatores, o carbono acaba formando um grande número de compostos, vejamos esses fatores:
• Capacidade de formar cadeias
O carbono é o único elemento químico que forma as cadeias mais longas, estáveis e variadas.
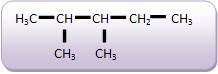
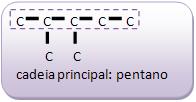
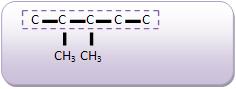
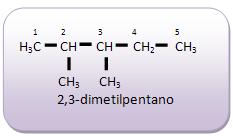
A fórmula C5 H12 , representa três tipos de compostos diferentes:
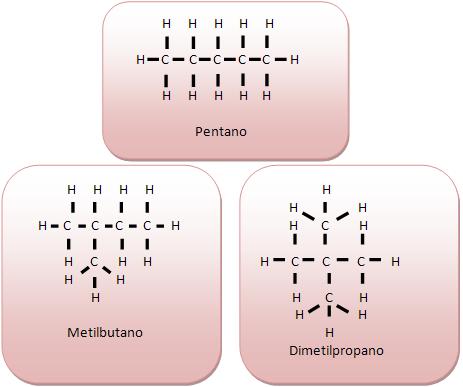
• Tetravalência do carbono
É necessário que o carbono determine quatro ligações covalentes ou com outros átomos de carbono, ou com átomos de outros não-metais.
• Habilidade para ligar-se a elemento mais eletropositivo ou mais eletronegativo
A posição do carbono aparece no segundo período da tabela periódica.

O carbono está no meio entre os elementos eletronegativos e eletropositivos, por isso pode se ligar a ambos os elementos ou ligar-se a elementos mais eletropositivos, como o hidrogênio ou elementos mais eletronegativos, como o cloro.
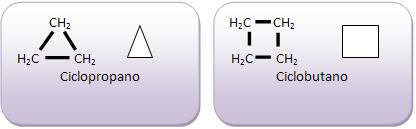
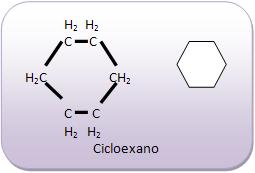
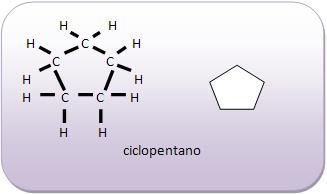
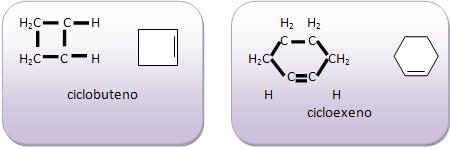
Todos os átomos de carbono, são capazes de formar cadeias acíclicas com muitos átomos, ou até mesmo anés de todos os tamanhos, lembrando que tanto os anéis como as cadeias acíclicas podem se ramificar.
Devido à alguns fatores, o carbono acaba formando um grande número de compostos, vejamos esses fatores:
• Capacidade de formar cadeias
O carbono é o único elemento químico que forma as cadeias mais longas, estáveis e variadas.
A fórmula C5 H12 , representa três tipos de compostos diferentes:

• Tetravalência do carbono
É necessário que o carbono determine quatro ligações covalentes ou com outros átomos de carbono, ou com átomos de outros não-metais.
• Habilidade para ligar-se a elemento mais eletropositivo ou mais eletronegativo
A posição do carbono aparece no segundo período da tabela periódica.

O carbono está no meio entre os elementos eletronegativos e eletropositivos, por isso pode se ligar a ambos os elementos ou ligar-se a elementos mais eletropositivos, como o hidrogênio ou elementos mais eletronegativos, como o cloro.
Todos os átomos de carbono, são capazes de formar cadeias acíclicas com muitos átomos, ou até mesmo anés de todos os tamanhos, lembrando que tanto os anéis como as cadeias acíclicas podem se ramificar.
http://www.colegioweb.com.br/quimica


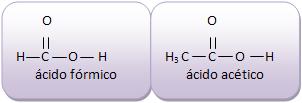
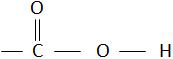 fazem parte da função ácido carboxílico.
fazem parte da função ácido carboxílico.