Observação - O elemento hidrogênio, por apresentar diferenças em relação aos demais elementos de seu grupo, não pertence a família 1A (ou 1).
Famílias B (3B a 2B) ou 3, 4, 5, 6, 7, 8, 9, 10, 11, 12
Abrangem os elementos chamados de transição.
O último nível desses elementos geralmente apresenta dois elétrons, e o penúltimo de nove a dezoito elétrons (nível em transição crescente).
Exemplos:
a) Escândio (Sc; 21): 2-8-9-2 (3B ou 3)
b) Titânio (Ti; 22): 2-8-10-2 (4B ou 4)
c) Ferro (Fe; 26): 2-8-14-2 (8B ou 8)
Observações:
1. As famílias 1B (ou 11) e 2B (ou 12) são casos particulares, pois, embora possuam a configuração eletrônica de elementos representativos, apresentam propriedades químicas de elementos de transição.
2. Note que a primeira família é 3B para que haja concordância do número da família com a valência do elemento químico.
Elementos de transição interna: lantanídeos e actinídeos
O último nível dos elementos de transição interna geralmente apresenta dois elétrons, e o penúltimo oito. O antepenúltimo cresce de 19 a 32 elétrons (nível interno em transição crescente).
Exemplos:
a) Cério (Ce; 58): 2-8-18-20-8-2
b) Prasiodímio (Pr; 59): 2-8-18-21-8-2
c) Plutônio (Pu; 94): 2-8-18-32-24-8-2
O elemento de transição interna mais importante é o urânio, usado nos reatores atômicos para produção de energia elétrica, o qual substitui quantidades fantásticas de petróleo.
Diferenciação dos três tipos de elementos por meio do último subnível
Elementos representativos
Podem terminar em subnível do tipo s (1A e 2A) ou do tipo p (3A a 8A), ambos pertencentes ao último nível de cada átomo (nível em crescimento).
Exemplos:
1) 12Mg: 1s2 2s2 2p6 3s2 (período 3 e família 2A ou 2)
2) 18Ar: 1s2 2s2 2p6 3s2 3p6 (período 3 e família 8A ou 18)
Observe a tabela abaixo que contém a configuração dos vinte primeiros elementos da tabela.
Elemento | Z | Configuração | Número de elétrons na camada de valência |
Hidrogênio | 1 | 1s1 | 1 |
Hélio | 2 | 1s2 | 2 |
Lítio | 3 | 1s2 2s1 | 1 |
Berílio | 4 | 1s2 2s2 | 2 |
Boro | 5 | 1s2 2s2 2p1 | 3 |
carbono | 6 | 1s2 2s2 2p2 | 4 |
Nitrogênio | 7 | 1s2 2s2 2p3 | 5 |
Oxigênio | 8 | 1s2 2s2 2p4 | 6 |
Flúor | 9 | 1s2 2s2 2p5 | 7 |
Neônio | 10 | 1s2 2s2 2p6 | 8 |
Sódio | 11 | 1s2 2s2 2p6 3s1 | 1 |
Magnésio | 12 | 1s2 2s2 2p6 3s2 | 2 |
Alumínio | 13 | 1s2 2s2 2p6 3s2 3p1 | 3 |
Silício | 14 | 1s2 2s2 2p6 3s2 3p2 | 4 |
Fósforo | 15 | 1s2 2s2 2p6 3s2 3p3 | 5 |
Enxofre | 16 | 1s2 2s2 2p6 3s2 3p4 | 6 |
Cloro | 17 | 1s2 2s2 2p6 3s2 3p5 | 7 |
Argônio | 18 | 1s2 2s2 2p6 3s2 3p6 | 8 |
Potássio | 19 | 1s2 2s2 2p6 3s2 3p6 4s1 | 1 |
Cálcio | 20 | 1s2 2s2 2p6 3s2 3p6 4s2 | 2 |
A partir dessa tabela concluímos que, o neônio – Z = 10 e o argônio – Z = 18, contém 8 elétrons no último nível. Já o nitrogênio – Z = 7 e o fósforo – Z 15, possuem 5 elétrons no último nível.
Podemos perceber que as configurações se repetem, depois de um intervalo de 8, isso ocorre conforme o número atômico aumenta.
Portanto podemos chegar à conclusão de que a configuração eletrônica é considerada uma função periódica de todos os números atômicos.
2. A lei periódica "As propriedades físicas e químicas dos elementos são funções periódicas de seus números atômicos". Lei de Moseley
Para exemplificar essa lei: o lítio, o sódio, e o potássio são metais parecidos, muitas propriedades químicas e físicas dos elementos acompanham uma representação que se repetem, essas propriedades são funções periódicas de suas massas atômicas elementos modificam-se, se o número atômica exceder.
A tabela periódica moderna
Mendeleev reformulou a organização da tabela periódica a partir dos pesos atômicos de seus elementos em ordem crescente, essa reorganização consiste na conclusão, de que o número atômico deve ser considerado como propriedade de classificação dos elementos.
Essa tabela é organizada da seguinte forma: elementos semelhantes estão organizados nas colunas verticais, que são chamadas de grupos ou famílias; elementos pouco semelhantes ou com nenhuma semelhança, estão organizados e são chamadas de períodos, e o número de elementos varia.
Observe os períodos abaixo:
- primeiro período: muito curto,2 elementos, H, He
- segundo período: curto, 8 elementos, Z – 3 a 18
- terceiro período: curto, 8 elementos,Z – 11 a 18
- quarto período: longo, 18 elementos, Z – 19 a 36
- quinto período: longo, 18 elementos, Z – 37 a 54
- sexto período: muito longo, 32 elementos, Z – 55 a 86
- sétimo período: incompleto, Z – 87 em diante.
Os subgrupos dos elementos são denominados entre, A e B, porém, os elementos de números atômicos 57 a 71 eram bastante parecidos, são colocados no subgrupo 3 – B, por esse motivo eles foram denominados metais terras raras ou lantanídeos.
No subgrupo 3 – B, podemos encontrar os actinídeos (elementos de número 89 a 103).
No subgrupo 5 – B, podemos encontrar o elemento 104. A partir do número atômico 93, são elementos radioativos artificiais e denominados transuranianos. Porém, atualmente a Tabela Periódica é organizada por numeração dos grupos, de 1 a 18, pode-se observar essa organização, no inicio do capítulo, que contém a ilustração de uma tabela.
Para elementos de números atômicos de 104 a 109, a União Internacional de Química Pura e Aplicada, tornou oficiais os seguintes nomes abaixo:
Em homenagem a Ernest Rutherford, elemento de Z = 104 – Rutherfórdio (Rf)
Em homenagem ao laboratório de Du-bna, elemento de Z = 105 – Dúbnio (Db)
Em homenagem a G. T. Saborg, elemento de Z = 106 – Seabórgio (Sg)
Em homenagem a Niesl Bohr, elemento de Z = 107 – Bóhrio (Bh)
Em homenagem a região onde se encontra o laboratório de Darmstadt, elemento de Z = 108 – Hássio (Hs)
Em homenagem Lise Meitner, elemento de Z = 109 – Meitnério (Mt)
Para os elementos novos que surgiram e que irão surgir, a IUPAC utiliza nomenclaturas temporárias.
4- Relações entre a estrutura atômica e a posição do elemento na classificação periódica
Nos subgrupos A, 1 – B e 2 – B, os elementos indicam números de elétrons na camada de valência idêntico ao número do grupo. No grupo A os elementos são denominados representativos ou típicos, o último elétron que se acrescenta na eletrosfera se localiza no subnível s ou p. Observe o exemplo:
Mg (2 – A ou 2), possui 2 elétrons externos.
Cu (1 – B ou 11) possui 1 elétron mais externo.
Nos subgrupos 3 – B, 4 – B, 5 – B, 6 – B, 7 – B e 8 – B, apresentam 1 ou 2 elétrons na camada mais remota. O subnível d incompleto é denominado metais de transição, como por exemplo, o ferro: Vejamos:
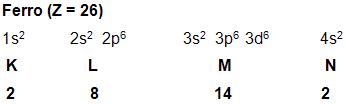
Vejamos agora algumas características específicas dos metais de transição:
• Eles apresentam mais de um número de oxidação pelo fato de tanto os elétrons da camada mais externa, como os dos orbitais d incompletos, fazerem parte da combinação. Dessa forma os íons Fe++ e Fe+++, possuem a seguinte distribuição eletrônica:
Fe++: 1s2 2s2 2p6 3s2 3p6 3d6
Fe+++: 1s2 2s2 2p6 3s2 3p6 3d5
O limite dessa variabilidade de valência varia entre superior e inferior. O limite superior é dado pelo mesmo número do grupo que ele faz parte, e o limite inferir é dado pelo número de elétrons encontrados no subnível s periférico, e de maneira geral são 2, menos para o grupo 6 – B neste caso o número é 1.
Dentre os limites superiores e inferiores existe uma camada de valência intermediaria em que o elemento pode apresentar o esquema abaixo:
Grupo | 3-B | 4-B | 5-B | 6-B | 7-B | 8-B |
Limite inferior | 2 | 2 | 2 | 1 | 2 | 2 |
Intermediários | 3 | 3 4 | 2 3 4 5 | 3 4 5 6 | 3 4 5 6 7 | |
Limite superior | 3 | 4 | 5 | 6 | 7 | 8 |
• Eles formam facilmente complexos, como por exemplo,
o Ferricianeto de potássio ( K3 [ Fe (CN)6 ] ) e o Ferrocianeto de potássio (K4 [ Fe (CN)]).
• Eles apresentam em soluções aquosas, e íons coloridos, observe o exemplo:
Fé+++ - vermelho ferrugem
Fé++ - verde
• Na camada de valência eles apresentam 1 ou 2 elétrons. Os metais de transição
interna são os actinídeos (referente a ocupação do subnível 5f, encontra-se no subgrupo 3 – B) e os lantanídeos (referente a ocupação eletrônica do subnível 4f, encontra-se no subgrupo 3 - B), por exemplo:
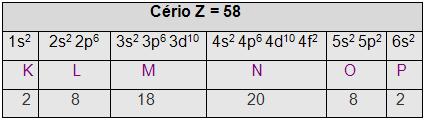
Elementos do grupo zero, indicam eletronicamente completos todos os subníveis iniciados, os gases nobres fazem parte desse grupo (zero),e possui 8 elétrons na camada K, porém os compostos de gases sintetizados não são em sua totalidade inertes, por exemplo: X e F4, X e O3, entre outros.
Observe abaixo o resumo das configurações eletrônicas, sendo o número quântico principal (n).

Notas:
1- Com relação ao cobre, ouro e prata, um dos elétrons do subnível ns2, irá passar para o subnível (n – 1) d9, contradizendo a regra de preenchimento. dessa forma o cobre (Z = 29) deve ter a seguinte distribuição:
1s2 2s2 2p6 3s2 3p6 3d9 4s2
Porém sua configuração é:
1s2 2s2 2p6 3s2 3p6 3d10 4s1
2- Uma das exceções do Diagrama de Linus Pauling, ocorre quando o cromo e molibdênio (grupo 6 - B), um elétrons do subnível ns2 transporta-se para o subnível (n - 1) d4. Cromo estaria com configuração de:
1s2 2s2 2p6 3s2 3p6 3d4 4s2
Mas sua configuração é :
1s2 2s2 2p6 3s2 3p6 3d5 4s1
3- Existem os semimetais ou metalóides, que estão entre os metais e os não-metais, por exemplo, o silício e o germânio, eles também podem ser utilizados na fabricação de transistores.

Silício
5- Propriedades periódicas e aperiódicas As propriedades periódicas são aquelas em que os valores variam, crescem ou decrescem, fazendo com que o número atômico aumente.
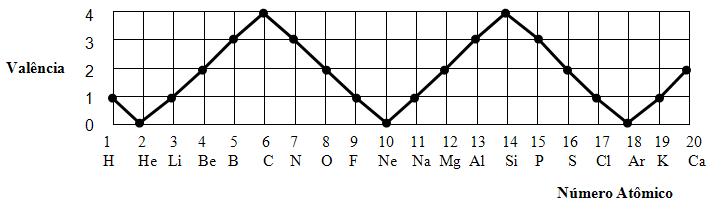
As propriedades aperiódicas são aquelas em que os valores variam, sempre crescem ou sempre decrescem, de acordo com o aumento do número atômico.
Podemos observar através da lei de Dulong-Petit, que calor específico – sempre decresce.

C – calor específico
A – massa atômica
6- Variação das propriedades de acordo com a posição na tabela periódica
Tamanho dos átomos
Carga nuclear
É o número de prótons, ele dispõe-se a aproximar os elétrons para perto do núcleo.
Efeito de Proteção dos elétrons Internos
É para evitar que os elétrons externos cheguem muito perto do núcleo.
Existe um problema, que é o de identificar qual dos fatores que atuam é mais forte, e produzem efeitos opostos.
Observe na ilustração abaixo que o átomo é maior que o seu cátion, e o ânion é maior que o átomo respectivo.
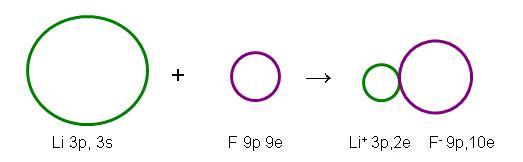
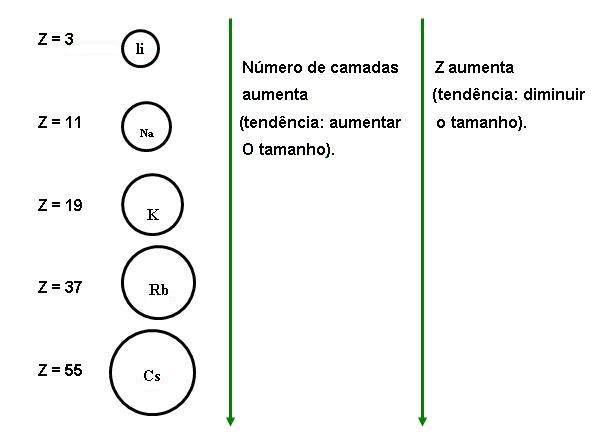
Variação do tamanho atômico dentro dos grupos:
Conforme ocorre aumento de número atômico, os átomos aumentam o tamanho, dentro do grupo, devido ao efeito dos níveis intermediários que aumenta o raio, predominando sobre o efeito de maior carga nuclear, resultando na diminuição do raio. Observe abaixo:
Variação do tamanho atômico dentro dos períodos:
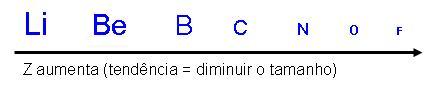
Observe que cada período de Li para f, os átomos diminuem de tamanho, pelo fato de ocorrer o aumento da carga no núcleo, e o número quântico principal não sofre alterações, portanto ele continua constante.
Raios atômicos, covalente, iônico e de Van de Waals:
Para medir a distância entre dois núcleos de dois átomos, utilizam-se medidas com raios-X em cristais, pois é difícil descobrir onde acaba um átomo pela pouca nitidez das nuvens de elétrons.
A distância d depende da ligação dos átomos, desta forma existem 4 tipos de raio, são os raio atômico, raio iônico, raio covalente, raio de Van Der Waals ou raios de colisão.
Vejamos cada um deles:
- Raio atômico
O raio atômico é considerado a metade da distância existente entre o centro de um átomo e o núcleo. Observe os exemplos dos raios atômicos dos metais alcalinos:
Li – 1,52 Å
Na – 1,86 Å
K – 2,31 Å
Rb – 2,44 Å
Cs – 2,62 Å
Fr – 2,7 Å
- Raio iônico
Quando falamos a respeito do cristal iônico, dizemos que a distância existente entre os íons de carga contrária é a soma dos raios iônicos tanto dos cátions como dos ânions.
Vejamos agora uma ilustração que nos mostra que certa distância representada po Y, é considerada a soma dos cátions e dos ânions, portanto podemos dizer que a distância X é considerada o dobro do raio do ânion.

C – calor específico
A – massa atômica
6- Variação das propriedades de acordo com a posição na tabela periódica
Tamanho dos átomos
Carga nuclear
É o número de prótons, ele dispõe-se a aproximar os elétrons para perto do núcleo.
Efeito de Proteção dos elétrons Internos
É para evitar que os elétrons externos cheguem muito perto do núcleo.
Existe um problema, que é o de identificar qual dos fatores que atuam é mais forte, e produzem efeitos opostos.
Observe na ilustração abaixo que o átomo é maior que o seu cátion, e o ânion é maior que o átomo respectivo.

Variação do tamanho atômico dentro dos grupos:
Conforme ocorre aumento de número atômico, os átomos aumentam o tamanho, dentro do grupo, devido ao efeito dos níveis intermediários que aumenta o raio, predominando sobre o efeito de maior carga nuclear, resultando na diminuição do raio. Observe abaixo:

Variação do tamanho atômico dentro dos períodos:
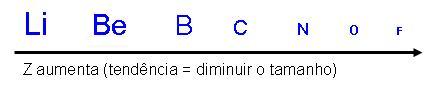
Observe que cada período de Li para f, os átomos diminuem de tamanho, pelo fato de ocorrer o aumento da carga no núcleo, e o número quântico principal não sofre alterações, portanto ele continua constante.
Raios atômicos, covalente, iônico e de Van de Waals:
Para medir a distância entre dois núcleos de dois átomos, utilizam-se medidas com raios-X em cristais, pois é difícil descobrir onde acaba um átomo pela pouca nitidez das nuvens de elétrons.
A distância d depende da ligação dos átomos, desta forma existem 4 tipos de raio, são os raio atômico, raio iônico, raio covalente, raio de Van Der Waals ou raios de colisão.
Vejamos cada um deles:
- Raio atômico
O raio atômico é considerado a metade da distância existente entre o centro de um átomo e o núcleo. Observe os exemplos dos raios atômicos dos metais alcalinos:
Li – 1,52 Å
Na – 1,86 Å
K – 2,31 Å
Rb – 2,44 Å
Cs – 2,62 Å
Fr – 2,7 Å
- Raio iônico
Quando falamos a respeito do cristal iônico, dizemos que a distância existente entre os íons de carga contrária é a soma dos raios iônicos tanto dos cátions como dos ânions.
Vejamos agora uma ilustração que nos mostra que certa distância representada po Y, é considerada a soma dos cátions e dos ânions, portanto podemos dizer que a distância X é considerada o dobro do raio do ânion.
- Raio covalente
Com relação a distância entre alguns átomos ligados através de uma ligação covalente, dizemos que ela é a união de dois raios covalentes. Caso os átomos sejam idênticos o raio será a metade da distância entre núcleos, ou seja:
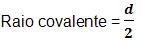
- Raio de Van der Waals ou raio de colisão

Johannes Diederik Van Der Waals, físico neerlandês.
É chamado raio de Van Der Waals ou raio de colisão, somente a metade da distância internuclear, porém quando os átomos não estão ligados através de ligações.
Com relação a distância entre alguns átomos ligados através de uma ligação covalente, dizemos que ela é a união de dois raios covalentes. Caso os átomos sejam idênticos o raio será a metade da distância entre núcleos, ou seja:
- Raio de Van der Waals ou raio de colisão

Johannes Diederik Van Der Waals, físico neerlandês.
É chamado raio de Van Der Waals ou raio de colisão, somente a metade da distância internuclear, porém quando os átomos não estão ligados através de ligações.
7- Potencial de ionização ou energia de ionização
Antes de qualquer coisa é importante lembrarmos que o primeiro potencial de ionização do átomo, é considerado toda energia que foi absorvida para tirar o elétron mais devagar que está ligado ao núcleo do átomo que está no estado gasoso isolado.
A segunda energia potencial de ionização, é para retirar o segundo elétron, com isso o terceiro, o quarto, o quinto e os demais potenciais, vão se definindo.
Observe o exemplo abaixo:
- Para retirar o elétron 3s de um átomo de sódio isolado a energia necessária é 5,14 eV.
- Já para retirar um elétron 2p do íon Na+ isolado a energia necessária é 47,3 eV.
Ou seja, eV é igual a elétron-volt = 1,6 x 10-19 joule.
Observe abaixo os raios atômicos do grupo A dos elementos
A caminho da tabela periódica
Antoine- Laurent Lavoisier (1743-1794), químico francês.
“O primeiro a classificar os elementos em grupo”, é considerado o criador da química moderna.
Johan Döbereiner (1780 -1849), professor de química na universidade de Iena
“Tríades”
John A. R. Newlands (1827), químico industrial inglês.
Propositor da “Lei das Oitavas”
Julius Lothar Meyer (1830-1885), alemão, era formado em medicina, mas preferiu a carreira de químico.
“Variação periódica do volume atômico com massa atômica”
Dimitri Ivanovitch Mendeleyev (1834-1907), químico nascido na Sibéria.
“Variação periódica das propriedades com a massa atômica”
Henry Gwin-Jeffreys Moseley(1887-1915), cientistas inglês, foi assistente de Rutherford.
“Trabalhos com números atômicos levaram à Tabela Periódica atual”
Para retirar o último elétron utilizando o segundo potencial de ionização, pois esse elétron está carregado possitivamente, e para separá-lo do íon positvo e do elétron negativo, é necessário a seguinte equação:
Na (g) + 5,14 eV→ Na+ (g) + e-
ou
Na (g) → Na+ (g) + e- - 5,14 eV
Variação do primeiro potencial de ionização na Tabela
É importante lembrarmos que com algumas exceções, o potencial de ionização irá aumentar da esquerda ara a direita.
Como já vimos anteriormente, se o elétron estiver muito próximo do seu núcleo, mais difícil será de afastá-los.
Observe abaixo um exemplo:
Os elementos com maior potencial de ionização, estão situados no lado direito da tabela, já os elementos com menor potencial estão situados no lado esquerdo da tabela.
Vejamos um gráfico:
Podemos observar no gráfico acima, que o número atômico forma uma curva, com diversos gases nobres, que são chamados nesta situação de máximos, e os alcalinos são denominados mínimos, também, é possível perceber que o gás hélio é o elemento que possui maior potencial de ionização, que é de 24,6 e V.
Caso ocorra uma ligação entre um não-metal, com alto potencial de ionização, e um de baixo potencial, ou seja, com um metal, esta ligação será iônica, e covalente quando for ligação de dois não-metais.
8- Afinidade eletrônica ou eletroafinidadeAfinidade eletrônica ou eletroafinidade é a energia que se forma quando um elétron é agregado a um átomo neutro.
Quando um elétron se junta com um átomo neutro de cloro, cria-se um íon negativo, liberando assim 3,75 eV, que pode ser considerada como afinidade eletrônica do cloro. Logo:Cl (g) + e- → Cl- (g) + 3,75 eV
Podemos afirmar também que a afinidade eletrônica do cloro, em determinada situação, é de 86,5 kcal/mol de átomos, na situação de acréscimo de um mol de elétron (6,02 x 1023 elétron) em apenas um mol de cloro.
Cl (g) + e- → Cl- (g) + 86,5 kcal/mol de átomos
Li | Be | B | C | N | O | F | Ne |
5,4 eV | 9,3 eV | 8,3 eV | 11,3 eV | 14,3 eV | 13,6 eV | 17,4 eV | 21,6 eV |
9- Eletronegatividade e eletropositividade
A eletronegatividade é considerada uma propriedade que tem por objetivo medir a propensão que o átomo tem para poder receber os elétrons.
O flúor é o elemento que possui mais eletronegatividade, para ele foi concedido o valor de 4,0 de eletronegatividade. Isso foi definido a partir dos estudos de Linus Pauling que concedeu dissemelhanças de eletronegatividade entre 0 e 4,(ele calculou grande parte dos elementos) para o hidrogênio foi atribuído o valor de 2,1 e a condição de ser o elemento padrão.
Observe abaixo alguns dos resultados da eletronegatividade, obtidos por Linus Pauling:
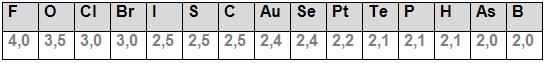
É importante atentar a alguns fatores que interferem e influenciam na eletronegatividade:
- Elementos que possuem mais de 4 elétrons na camada de valência estão propensos a adquirir elétrons, conclui-se que há alta eletronegatividade e baixa eletropositividade.
Elementos que possuem menos de 4 elétrons na camada de valência estão propensos a perder elétrons, conclui-se então que há baixa eletronegatividade e alta eletropositividade.
- Os átomos de tamanhos menores estão propensos a exibir maior eletronegatividades, que os átomos com tamanhos maiores, então em um grupo o tamanho de um átomo aumenta de cima para baixo, na tabela periódica, o que resulta em uma eletronegatividade decrescente no mesmo sentido (de cima para baixo), portanto a eletronegatividade diminui do flúor para o iodo, isso ocorre no grupo VII.
Vejamos:
- Caso os átomos sejam quase do mesmo tamanho, a eletronegatividade será de acordo com a carga nuclear, portanto quanto maior a carga maior a eletronegatividade.
Observe o esquema abaixo:
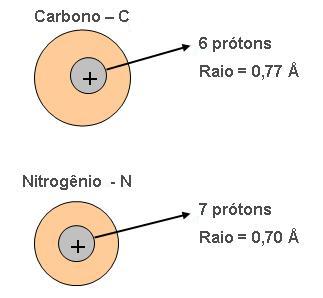
O nitrogênio é mais eletronegativo que o carbono. Então se conclui que nesse período a carga aumenta a eletronegatividade, da esquerda para a direita.
Vejamos agora a regra de Linus Pauling:
Para uma ligação ser iônica, segunda a regra de Linus Pauling deve haver uma dissemelhança de eletronegatividade entre os dois átomos maiores que 1,7. Já para uma ligação ser covalente, essa dissemelhança entre os dois átomos menores que 1,7. Portanto podemos concluir que quanto maior for essa dissemelhança, mais polar a ligação será.
Observe os exemplos:
NaCl
Cl – 3,0
Na – 0,9
Diferença de 2,1, portanto NaCl é iônico.
HCl
Cl – 3,0
H – 2,1
Diferença de 0,9, portanto HCl é covalente.
Na+I- Diferença de 1,6 porém é iônico.
A eletropositividade ou caráter metálico é a propriedade de medida para saber a tendência de um átomo para perder elétrons, ou seja, o oposto de eletronegatividade, quanto mais um elemento for eletropositivo, maior será o caráter metálico.
Portanto, o césio e o frâncio são elementos que possuem mais eletropositividade, e o flúor é o elemento que possui menos eletropositividade.
10- Reatividade química
A reatividade de um elemento está relacionada com a perda ou ganha de elétrons. Quanto maior a eletropositividade, maior a reatividade, isso no caso dos metais, como por exemplo, césio (Cs) e frâncio (Fr), considerados os mais reativos. E no caso dos não-metais é a eletronegatividade que deve ser maior que a reatividade, como por exemplo, o flúor que é o não metal maios reativo.

Flúor
Essa reatividade dos elementos nos períodos aumenta para ambos os lados (direita e esquerda), já nos grupos é para baixo para perto do canto esquerdo, e para cima no canto direito e para cima, observe abaixo:

Sódio metálico
13- Ponto de fusão e ponto de ebulição
O ponto de fusão (PF) é a temperatura que uma substância alcança, para passar do estado sólido para o estado líquido.
O ponto de ebulição (PE) é a temperatura que uma substância alcança, para passar do estado líquido para o gasoso.
Na situação normal dos elementos eles possuem os seguintes estados físicos:
No estado líquido encontramos o bromo que é um não-metal, e os metais tais como o frâncio e o mercúrio.

Mercúrio
No estado gasoso encontramos o cloro, oxigênio, flúor, nitrogênio, hidrogênio e gases nobres.

gás nitrogênio
No estado sólido estão os elementos que não foram citados acima.

titânio
O ponto de fusão e de ebulição de elementos em um período se dá das extremidades para o centro.
O ponto de fusão do metal gálio é de 30°C, ele pode derreter na palma da mão.

Metal gálio
17. Previsão de propriedades
É possível prever qual será o valor da propriedade de um elemento, para isso é necessário descobrir qual é a média dos valores da propriedade de elementos que estão localizados perto do mesmo grupo, observe o exemplo:
Lítio – raio atômico de 152 picômetros
Potássio – raio de 227 picômetros
Para calcular o raio atômico do sódio:
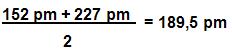
Logo, o raio atômico do sódio seria 186 pm.
É possível prever qual será o valor da propriedade de um elemento, para isso é necessário descobrir qual é a média dos valores da propriedade de elementos que estão localizados perto do mesmo grupo, observe o exemplo:
Lítio – raio atômico de 152 picômetros
Potássio – raio de 227 picômetros
Para calcular o raio atômico do sódio:
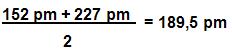
Logo, o raio atômico do sódio seria 186 pm.
16- HistóricoDobereiner – 1829

Johan Döbereiner (1780 -1849), professor de química na universidade de Iena.
Criador das Tríades, ele agrupou elementos parecidos em três conjuntos, e chegou à conclusão que a massa atômica de um elemento estava relacionada com a média aritmética das massas atômicas das outras duas tríades, observe o exemplo abaixo:
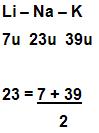
Chancourtois – 1863

Alexandre-Emile Béguyer de Chancourtois (1820-1886) francês.
Ele utilizou um cilindro, traçou uma hélice (que foi denominado “Parafuso Telúrico”). É importante lembrarmos que todos os elementos que são parecidos, aparecem na mesma geratriz
do cilindro. Vejamos:
Newlands – 1864

John A. R. Newlands (1827), químico industrial inglês.
Formulador da “Lei das Oitavas”
Ele organizou os elementos verticalmente em colunas com sete elementos cada, na ordem crescente de massas atômicas. Com isso ele conseguiu perceber que organizando os elementos de sete me sete, iria haver uma repetição de propriedades. E foi assim que se deu origem à Lei das Oitavas.
Mendeleyev – 1869

Dimitri Ivanovitch Mendeleyev (1834-1907), químico nascido na Sibéria.
“Variação periódica das propriedades com a massa atômica”
“As propriedades físicas e químicas dos elementos são funções periódicas de suas massas atômicas”, Mendeleyev utilizou esse princípio para estruturar sua tabela, que a partir dela foi desenvolvida a tabela moderna.
A tabela era dividida em oito partes verticais, e onze partes horizontais, organizada em ordem crescente das massas dos elementos, observe abaixo:
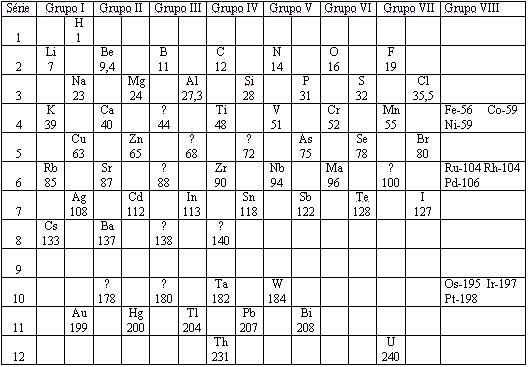
Só havia o conhecimento de 60 elementos, entretanto, Mendeleyev deixou espaços em branco para possíveis descobertas de elementos, com massas atômicas de 44, 68, 72 e 100.
O elemento escândio, que fora descoberto mais tarde já era previsto por Mendeleyev, ele havia deixado um espaço entre o cálcio e o titânio, no qual ele chamava de “eka-boro”, ou seja, abaixo do boro.
Após essa tabela, Lothar Meyer desenvolveu uma tabela mais aprimorada, e mais completa.
A eletronegatividade é considerada uma propriedade que tem por objetivo medir a propensão que o átomo tem para poder receber os elétrons.
O flúor é o elemento que possui mais eletronegatividade, para ele foi concedido o valor de 4,0 de eletronegatividade. Isso foi definido a partir dos estudos de Linus Pauling que concedeu dissemelhanças de eletronegatividade entre 0 e 4,(ele calculou grande parte dos elementos) para o hidrogênio foi atribuído o valor de 2,1 e a condição de ser o elemento padrão.
Observe abaixo alguns dos resultados da eletronegatividade, obtidos por Linus Pauling:
É importante atentar a alguns fatores que interferem e influenciam na eletronegatividade:
- Elementos que possuem mais de 4 elétrons na camada de valência estão propensos a adquirir elétrons, conclui-se que há alta eletronegatividade e baixa eletropositividade.
Elementos que possuem menos de 4 elétrons na camada de valência estão propensos a perder elétrons, conclui-se então que há baixa eletronegatividade e alta eletropositividade.
- Os átomos de tamanhos menores estão propensos a exibir maior eletronegatividades, que os átomos com tamanhos maiores, então em um grupo o tamanho de um átomo aumenta de cima para baixo, na tabela periódica, o que resulta em uma eletronegatividade decrescente no mesmo sentido (de cima para baixo), portanto a eletronegatividade diminui do flúor para o iodo, isso ocorre no grupo VII.
Vejamos:

- Caso os átomos sejam quase do mesmo tamanho, a eletronegatividade será de acordo com a carga nuclear, portanto quanto maior a carga maior a eletronegatividade.
Observe o esquema abaixo:

O nitrogênio é mais eletronegativo que o carbono. Então se conclui que nesse período a carga aumenta a eletronegatividade, da esquerda para a direita.
Vejamos agora a regra de Linus Pauling:
Para uma ligação ser iônica, segunda a regra de Linus Pauling deve haver uma dissemelhança de eletronegatividade entre os dois átomos maiores que 1,7. Já para uma ligação ser covalente, essa dissemelhança entre os dois átomos menores que 1,7. Portanto podemos concluir que quanto maior for essa dissemelhança, mais polar a ligação será.
Observe os exemplos:
NaCl
Cl – 3,0
Na – 0,9
Diferença de 2,1, portanto NaCl é iônico.
HCl
Cl – 3,0
H – 2,1
Diferença de 0,9, portanto HCl é covalente.
Na+I- Diferença de 1,6 porém é iônico.
A eletropositividade ou caráter metálico é a propriedade de medida para saber a tendência de um átomo para perder elétrons, ou seja, o oposto de eletronegatividade, quanto mais um elemento for eletropositivo, maior será o caráter metálico.
Portanto, o césio e o frâncio são elementos que possuem mais eletropositividade, e o flúor é o elemento que possui menos eletropositividade.
10- Reatividade química
A reatividade de um elemento está relacionada com a perda ou ganha de elétrons. Quanto maior a eletropositividade, maior a reatividade, isso no caso dos metais, como por exemplo, césio (Cs) e frâncio (Fr), considerados os mais reativos. E no caso dos não-metais é a eletronegatividade que deve ser maior que a reatividade, como por exemplo, o flúor que é o não metal maios reativo.

Flúor
Essa reatividade dos elementos nos períodos aumenta para ambos os lados (direita e esquerda), já nos grupos é para baixo para perto do canto esquerdo, e para cima no canto direito e para cima, observe abaixo:


Sódio metálico
13- Ponto de fusão e ponto de ebulição
O ponto de fusão (PF) é a temperatura que uma substância alcança, para passar do estado sólido para o estado líquido.
O ponto de ebulição (PE) é a temperatura que uma substância alcança, para passar do estado líquido para o gasoso.
Na situação normal dos elementos eles possuem os seguintes estados físicos:
No estado líquido encontramos o bromo que é um não-metal, e os metais tais como o frâncio e o mercúrio.

Mercúrio
No estado gasoso encontramos o cloro, oxigênio, flúor, nitrogênio, hidrogênio e gases nobres.

gás nitrogênio
No estado sólido estão os elementos que não foram citados acima.

titânio
O ponto de fusão e de ebulição de elementos em um período se dá das extremidades para o centro.
O ponto de fusão do metal gálio é de 30°C, ele pode derreter na palma da mão.

Metal gálio
17. Previsão de propriedades
É possível prever qual será o valor da propriedade de um elemento, para isso é necessário descobrir qual é a média dos valores da propriedade de elementos que estão localizados perto do mesmo grupo, observe o exemplo:
Lítio – raio atômico de 152 picômetros
Potássio – raio de 227 picômetros
Para calcular o raio atômico do sódio:
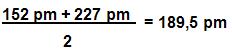
Logo, o raio atômico do sódio seria 186 pm.
11- Densidade
Densidade absoluta é a analogia, entre a massa e o volume de algum elemento, pode ser chamada também de massa específica, e é representada na seguinte formula:
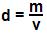
A densidade depende de diversos fatores:
• Massa do núcleo;
• Dimensão do átomo;
• Se esses átomos estão comprimidos ou não;
Portanto podemos concluir que a densidade do elemento irá depender tanto do volume dos poros deixados pelos átomos, quanto da densidade dos átomos.
Sabe-se que os metais mais densos são:
Ósmio – d = 22,48 g/cm3
Platina – d = 21,45 g/cm3
Irídio – d = 22,4 g/cm3
Lembrando que o metal mais leve, ou seja, que contêm menos água é o lítio.
17. Previsão de propriedades Densidade absoluta é a analogia, entre a massa e o volume de algum elemento, pode ser chamada também de massa específica, e é representada na seguinte formula:
A densidade depende de diversos fatores:
• Massa do núcleo;
• Dimensão do átomo;
• Se esses átomos estão comprimidos ou não;
Portanto podemos concluir que a densidade do elemento irá depender tanto do volume dos poros deixados pelos átomos, quanto da densidade dos átomos.
Sabe-se que os metais mais densos são:
Ósmio – d = 22,48 g/cm3
Platina – d = 21,45 g/cm3
Irídio – d = 22,4 g/cm3
Lembrando que o metal mais leve, ou seja, que contêm menos água é o lítio.
É possível prever qual será o valor da propriedade de um elemento, para isso é necessário descobrir qual é a média dos valores da propriedade de elementos que estão localizados perto do mesmo grupo, observe o exemplo:
Lítio – raio atômico de 152 picômetros
Potássio – raio de 227 picômetros
Para calcular o raio atômico do sódio:
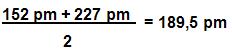
Logo, o raio atômico do sódio seria 186 pm.
16- HistóricoDobereiner – 1829

Johan Döbereiner (1780 -1849), professor de química na universidade de Iena.
Criador das Tríades, ele agrupou elementos parecidos em três conjuntos, e chegou à conclusão que a massa atômica de um elemento estava relacionada com a média aritmética das massas atômicas das outras duas tríades, observe o exemplo abaixo:
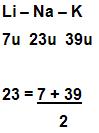
Chancourtois – 1863

Alexandre-Emile Béguyer de Chancourtois (1820-1886) francês.
Ele utilizou um cilindro, traçou uma hélice (que foi denominado “Parafuso Telúrico”). É importante lembrarmos que todos os elementos que são parecidos, aparecem na mesma geratriz
do cilindro. Vejamos:

John A. R. Newlands (1827), químico industrial inglês.
Formulador da “Lei das Oitavas”
Ele organizou os elementos verticalmente em colunas com sete elementos cada, na ordem crescente de massas atômicas. Com isso ele conseguiu perceber que organizando os elementos de sete me sete, iria haver uma repetição de propriedades. E foi assim que se deu origem à Lei das Oitavas.
Mendeleyev – 1869

Dimitri Ivanovitch Mendeleyev (1834-1907), químico nascido na Sibéria.
“Variação periódica das propriedades com a massa atômica”
“As propriedades físicas e químicas dos elementos são funções periódicas de suas massas atômicas”, Mendeleyev utilizou esse princípio para estruturar sua tabela, que a partir dela foi desenvolvida a tabela moderna.
A tabela era dividida em oito partes verticais, e onze partes horizontais, organizada em ordem crescente das massas dos elementos, observe abaixo:

Só havia o conhecimento de 60 elementos, entretanto, Mendeleyev deixou espaços em branco para possíveis descobertas de elementos, com massas atômicas de 44, 68, 72 e 100.
O elemento escândio, que fora descoberto mais tarde já era previsto por Mendeleyev, ele havia deixado um espaço entre o cálcio e o titânio, no qual ele chamava de “eka-boro”, ou seja, abaixo do boro.
Após essa tabela, Lothar Meyer desenvolveu uma tabela mais aprimorada, e mais completa.




pouquinha coisa em Professor. Chrisciely 1º EM B João Cruz
ResponderExcluir