1. Átomo e elemento químico
Do latim atomu, quer dizer indivisível;
O átomo é considerado a menor partícula que pode dar característica aos elementos químicos.
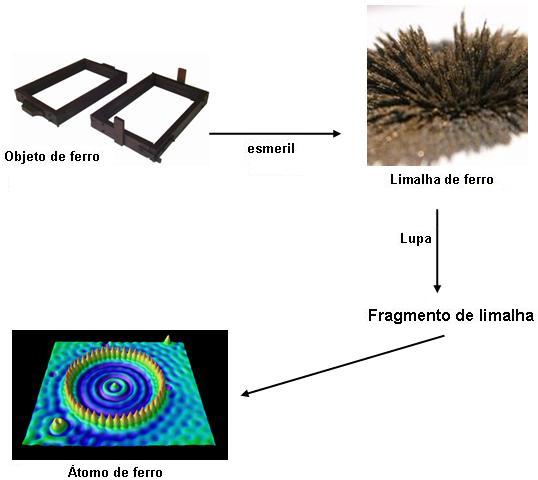
Por volta de 1808, Dalton apresentou a concepção cientifica do átomo, ou seja, um trabalho que surgiu a partir das leis ponderais das reações químicas. Onde essas leis foram definidas através de algumas experiências. Vejamos um exemplo com ferro. Lembrando que o ferro é composto por átomos de ferra, sendo assim considerado um elemento químico.
Um pedaço de ferro:
Do latim atomu, quer dizer indivisível;
O átomo é considerado a menor partícula que pode dar característica aos elementos químicos.
Por volta de 1808, Dalton apresentou a concepção cientifica do átomo, ou seja, um trabalho que surgiu a partir das leis ponderais das reações químicas. Onde essas leis foram definidas através de algumas experiências. Vejamos um exemplo com ferro. Lembrando que o ferro é composto por átomos de ferra, sendo assim considerado um elemento químico.
Um pedaço de ferro:

2. Molécula e substância
Do latim molécula, diminutivo de mole, grande massa.
A molécula é considerada a menor partícula que uma substância pode ter, conservando assim algumas características de composição e propriedades químicas da substância.
Vejamos agora um exemplo, onde os átomos se unem formando alguns conjuntos definidos, chamados de moléculas:
Exemplos:

3. Unidade de massa atômica
Essa unidade é considerada um padrão compatível, para poder determinar a massa de um átomo.
A unidade de massa atômica unificada (u) é 1/12 da massa de um átomo de carbono isótopo 12.
Em gramas essa unidade de massa atômica é: 1u = 1,66. 10-24g.
Essa massa é usada para apresentar a idéia de massa de moléculas e de átomos.

4. Massa atômica
A massa atômica é considerada a massa do átomo em unidade de massa atômica, ou seja, 1/12 da massa de um átomo é um carbono-12.
Por exemplo:
Vamos imaginar uma balança, e de um lado vamos imaginar que em um dos pratos da balança tenha um átomo de flúor, e que para que essa balança fique equilibrada, no outro prato da balança tenha uma unidade de massa atômica. Conseqüentemente o átomo de flúor é mais pesado que uma unidade de massa atômica. Já se mantermos o átomo de flúor de um lado da balança e no outro lado colocarmos 19 unidades de massa atômica, veremos que a balança irá se equilibrar, portanto podemos concluir que a massa atômica do flúor vale 19 unidades da massa atômica.
Veja a ilustração:


Nenhum comentário:
Postar um comentário