Neste capítulo estudaremos as reações químicas que acontecem de maneira geral, com transferência de elétron. Lembrando que as equações podem representar as equações.
É preciso seguir algumas regras, criadas por químicos, para ser possível acompanhar a transferência dos elétrons nas equações, a partir dessas regras é possível calcular o número de oxidação.
Vejamos:

Lembrando que essa grande reação citada acima irá ser estudada ainda neste capítulo.
2. Significação do número de oxidação
Nos compostos iônicos
Em todos os compostos iônicos, os números de oxidação serão correspondentes à carga elétrica do íon.
A carga desses compostos, do íon ferro é de +3, e di íon cloreto é de -1.
FeC0l3
Nox do Fe = +3
Nox do Cl = -1
Nos compostos covalentes
Não existem íons nesses compostos, devido à ligação que se forma por compartilhamento de elétrons. Com isso o número de oxidação será uma carga imaginária onde o átomo irá possuir.
Vejamos abaixo a fila de eletronegatividade em ordem decrescente.
F O N Cl Br I S C P H...
3. Número de (nox) – regras práticas para o cálculo.Vejamos as respectivas regras:
Regra 1
Em um composto a soma de todos os números de oxidação é zero.
Regra 2
O número de oxidação presentes nos átomos das substâncias simples é zero.
São responsáveis por indicar que na molécula de hidrogênio (H2) o número de oxidação é igual a zero, em cada átomo.
Regra 3
Os que também possuem número de oxidação zero são os átomos que não se combinam.
Regra 3
Os que também possuem número de oxidação zero são os átomos que não se combinam.
Regra 4 Os que possuem número de oxidação +1 são os metais alcalinos (Li, Na, K, Rb, Cs, Fr) e a prata (Ag).
Regra 5
Os compostos que possuem número de oxidação +2, são os alcalino terrosos (Be, Mg, Ca, Sr, Ba, Ra) e o zinco (Zn).
Regra 6
Nos compostos o alumínio possui número de oxidação +3.
Regra 7
Nos compostos o hidrogênio possui +1, e combinados com metais os hidretos metálicos possuem -1.
Regra 8
Nos compostos o oxigênio é -2, nos peróxidos é -1.
Regra 9
Na parte direita da fórmula, os halogênios (F, Cl, Br e I), possuem número de oxidação -1.
Regra 10
A carga do íon é o número de oxidação nos íons monoatômicos.
Nos compostos o alumínio possui número de oxidação +3.
Regra 7
Nos compostos o hidrogênio possui +1, e combinados com metais os hidretos metálicos possuem -1.
Regra 8
Nos compostos o oxigênio é -2, nos peróxidos é -1.
Regra 9
Na parte direita da fórmula, os halogênios (F, Cl, Br e I), possuem número de oxidação -1.
Regra 10
A carga do íon é o número de oxidação nos íons monoatômicos.
4. Conceito de oxidação e redução
Oxidação
Se tratando de oxidação, podemos dizer que ela é considerada a transformação onde ocorre um aumento do número de oxidação das espécies químicas.
A oxidação é relacionada com um fenômeno químico (combinar com o oxigênio), portanto toda espécie que combinar com o oxigênio, irá sofrer uma oxidação. Já se um átomo se combinar com o oxigênio, ele terá a tendência de perder elétrons, aumentando assim o número de oxidação no carbono.
Oxidação
Se tratando de oxidação, podemos dizer que ela é considerada a transformação onde ocorre um aumento do número de oxidação das espécies químicas.
A oxidação é relacionada com um fenômeno químico (combinar com o oxigênio), portanto toda espécie que combinar com o oxigênio, irá sofrer uma oxidação. Já se um átomo se combinar com o oxigênio, ele terá a tendência de perder elétrons, aumentando assim o número de oxidação no carbono.
CONCEITO DE OXIDORREDUÇÃO:
Vamos imaginar que um prego de ferro, sofreu uma oxidação, ou seja, ele perdeu elétrons, logo se colocarmos em forma de equação, veremos que o seu número de oxidação aumentou.
Vejamos:
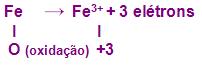
Portanto a partir das afirmações acima, podemos dizer que o fenômeno oxidação “significa” a perda de elétrons.
Redução
Se tratando de redução, podemos dizer que ela é considerada uma transformação onde ocorre uma diminuição do número de oxidação de uma espécie química.
Observe abaixo a reação entre magnésio e oxigênio, no formato eletrônico.
Mg (Z = 12)
O (Z = 8)
Vejamos:
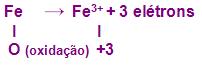
Portanto a partir das afirmações acima, podemos dizer que o fenômeno oxidação “significa” a perda de elétrons.
Redução
Se tratando de redução, podemos dizer que ela é considerada uma transformação onde ocorre uma diminuição do número de oxidação de uma espécie química.
Observe abaixo a reação entre magnésio e oxigênio, no formato eletrônico.
Mg (Z = 12)
O (Z = 8)
K | L | M |
2 | 8 | 2 |
2 | 6 |
Obs.: o flúor é o único elemento cujo os átomos não perdem elétrons ao se combinarem, ao contrário de todos os átomos.
Vejamos agora uma figura que nos mostra que o magnésio sofreu uma oxidação, perdendo assim dois elétrons, consequentemente o oxigênio sofreu uma redução, ganhando assim dois elétrons. Vejamos a ilustração abaixo:
Observando a figura nota-se que o magnésio perdeu 2 elétrons, ocorrendo a oxidação, neste caso o oxigênio recebeu 2 elétrons, decorrente da redução que sofreu.


5. Oxidantes e redutores
Oxidante é a substância ou elemento que se utiliza para fazer com que ocorra a oxidação em outra espécie, ou seja, o oxidante promove a oxidação. Ele possui átomo que sofre redução.
Redutor é a substância ou elemento que se utiliza para promover a redução em outra espécie, ou seja, ele promove a redução. Ele possui átomo que sofre oxidação.
Quando um oxidante promove a oxidação, ele recebe elétrons e consequentemente sofre uma redução.
Já o redutor nesse processo, ao fazer uma redução dá elétrons e sofre uma oxidação.
Logo, na reação entre magnésio e oxigênio, magnésio é redutor (sofre oxidação), e oxigênio é oxidante (sofre redução).
Oxidante é a substância ou elemento que se utiliza para fazer com que ocorra a oxidação em outra espécie, ou seja, o oxidante promove a oxidação. Ele possui átomo que sofre redução.
Redutor é a substância ou elemento que se utiliza para promover a redução em outra espécie, ou seja, ele promove a redução. Ele possui átomo que sofre oxidação.
Quando um oxidante promove a oxidação, ele recebe elétrons e consequentemente sofre uma redução.
Já o redutor nesse processo, ao fazer uma redução dá elétrons e sofre uma oxidação.
Logo, na reação entre magnésio e oxigênio, magnésio é redutor (sofre oxidação), e oxigênio é oxidante (sofre redução).
6. Significado dos termos de oxidorredução
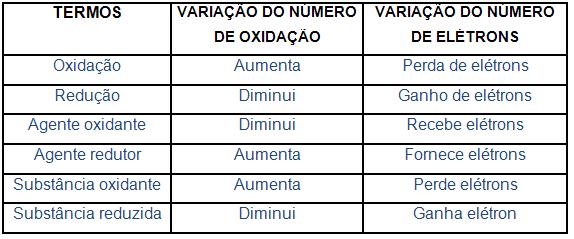

7. Reações de oxidorredução
As reações de oxidorredução acontecem com transferência de elétrons, desta forma ocorrem variações do número de oxidação.
Observe que como temos 2 átomos de cromo, teremos também 6 elétrons ganhos.
Observe que cada bromo cedeu 1 elétron, mas 8 átomos de bromo continuaram -1, desta forma conclui-se que 6 dos 14 átomos sofreram oxidação, fornecendo 6 elétrons. O número de elétrons cedidos é igual ao número total de elétrons recebidos.
9. Tipos de acerto de coeficientes
Já sabemos que o número de elétrons dados e recebidos tem de ser igual para que seja possível o balanceamento de coeficiente por oxidorredução.
As equações foram organizadas didaticamente, para o acerto dos coeficientes. Vejamos:
- Primeiro caso
Sabemos que uma substância não irá fazer parte da moldura caso o Nox esteja aparecendo mais de uma vez.
Por exemplo:
KMNO4 + HCl → KCl + MnCl2 + Cl2 + H2O
HCl não pode ir para moldura, pelo fato de Cl ser = -1 , que também há em KCl e MnCl2.
Já sabemos que o número de elétrons dados e recebidos tem de ser igual para que seja possível o balanceamento de coeficiente por oxidorredução.
As equações foram organizadas didaticamente, para o acerto dos coeficientes. Vejamos:
- Primeiro caso
Sabemos que uma substância não irá fazer parte da moldura caso o Nox esteja aparecendo mais de uma vez.
Por exemplo:
KMNO4 + HCl → KCl + MnCl2 + Cl2 + H2O
HCl não pode ir para moldura, pelo fato de Cl ser = -1 , que também há em KCl e MnCl2.
- Segundo caso
Reação de desproporcionamento, ou seja, quando uma substância aparece em dois ramais.
Por exemplo:
Reação de desproporcionamento, ou seja, quando uma substância aparece em dois ramais.
Por exemplo:
Com base no exemplo acima, podemos perceber que Cl2 está presente tanto na redução (0 → -1) quanto na oxidação (0 → +5). Pelo fato de não sabermos que parte do Cl2 sofreu oxidação e que parte sofreu redução, não podemos colocar Cl2 na moldura. Quando isso ocorre é aconselhável colocar na moldura as substâncias que não estão presentes nos dois ramais, NaCl e NaClO3.
Observe a equação:
Cl2 + NaOH → NaCl + NaClO3 + H2O
Onde:
Cl2 é o oxidante, por conter o elemento que sofreu redução, e também é redutor, por conter o elemento que sofreu oxidação.
Isso diz respeito a uma auto-oxidorredução, observe o balanceamento. Vejamos:
O Cl2 é um auto-oxidante-redutor nesta auto-oxidorredução, onde o NaCl e o NaClO3 serão colocados nos quadros.
Logo:
Se utilizarmos o método das tentativas iremos obter:
3Cl2 + 6NaOH → 5NaCl + 1NaClO3 + 3H2O
O desproporcionamento ou auto-oxidorredução, diz respeito à oxidação e redução simultânea do mesmo elemento de uma determinada substância.
- Terceiro caso
Esse caso se relaciona às equações que abrangem a água oxigenada.
A água oxigenada é capaz de agir como oxidante e como redutor.
A água oxigenada (H2O2) possui o oxigênio com Nox = -1, caso o oxigênio apareça com Nox zero, ou seja, O2 será resultado de uma oxidação (-1→0), portanto podemos concluir que H2O2 sofreu a oxidação e portanto foi um redutor.
É importante lembrarmos que a água oxigenada, pode se transformar em água, onde a água oxigenada sofre uma redução, o que faz com que H2O2 se torne oxidante. Vejamos:
Observe a equação:
Cl2 + NaOH → NaCl + NaClO3 + H2O
Onde:
Cl2 é o oxidante, por conter o elemento que sofreu redução, e também é redutor, por conter o elemento que sofreu oxidação.
Isso diz respeito a uma auto-oxidorredução, observe o balanceamento. Vejamos:
O Cl2 é um auto-oxidante-redutor nesta auto-oxidorredução, onde o NaCl e o NaClO3 serão colocados nos quadros.
Logo:
Se utilizarmos o método das tentativas iremos obter:
3Cl2 + 6NaOH → 5NaCl + 1NaClO3 + 3H2O
O desproporcionamento ou auto-oxidorredução, diz respeito à oxidação e redução simultânea do mesmo elemento de uma determinada substância.
- Terceiro caso
Esse caso se relaciona às equações que abrangem a água oxigenada.
A água oxigenada é capaz de agir como oxidante e como redutor.
A água oxigenada (H2O2) possui o oxigênio com Nox = -1, caso o oxigênio apareça com Nox zero, ou seja, O2 será resultado de uma oxidação (-1→0), portanto podemos concluir que H2O2 sofreu a oxidação e portanto foi um redutor.
É importante lembrarmos que a água oxigenada, pode se transformar em água, onde a água oxigenada sofre uma redução, o que faz com que H2O2 se torne oxidante. Vejamos:
Observe que ocorreu uma perda de cor do permanganato de potássio.
Ocorreu uma redução em Mn, pois passou de +7 para +2, em H2O2 deve ocorrer oxidação, Vejamos:
- Quarto caso Esse caso se refere a maior parte das equações referentes a reações que ficam em meio aquoso. Para poder calcular Nox em íons será necessária tomar conhecimento das regras
11. Acerto de coeficientes em equações iônicas
Análise a equação abaixo:
Cr2O2-7+ Cl- + H+ → Cr3+ + H2O + Cl2
Observe agora o cálculo dos Nox das espécies, e os ramais traçados.
As substâncias Cl- e Cl2, e Cr2 O2-7 e Cr3+ podem ir à moldura, pois não repetem. É mais apropriado para prosseguir com o balanceamento, escolher espécies na qual os elementos de Nox variado obtenham maior atomicidade, portanto escolhemos Cl2, Cr2 O2-7, pelo fato de que em Cr2 O=7 existem maior número de átomos de cromo. Vejamos:
Observe agora como ficaria a resolução pelo método de tentativas.
1Cr2O=7+ 6Cl- + 14H+ → 2Cr+++ + 7H2O + 3Cl2
Observe se as cargas estão de acordo:
-2 -6 + 14 → +6
1ª membro 2ª membro
As partículas na qual acorreram transformações, são escritas em uma equação iônica, na equação que acorreu apenas o ânion foi descrito como Cr2 O2-7.
O cátion (Na+, K+ etc.) não foi descrito na reação pelo fato de ter ficado intacto na reação.
Vamos observar agora a equação iônica abaixo:
2KmnO4 + 16HCl → 2MnCl2 + 2KCl + 5 Cl2 + 8H2O
As substâncias dissociadas são:
2K+ + 2MnO-4 + 16H+ + 16Cl- → 2Mn2+ + 4Cl- + 2K+ + 2Cl- + 5Cl2 + 8H2O
Vejamos agora as partículas que ficaram intactas, simplificadas:
2MnO-4 + 16H+ + 10Cl- → 2Mn2+ + 5Cl2 + 8H2O
Caso ocorra dificuldades para o ajustamento por tentativa é necessário utilizar uma incógnita x como coeficiente de um íon, para poder continuar o ajustamento por tentativa.
Por exemplo:
Pelo método de tentativa observe o ajuste:
1Cr2O=7 + 3H2O2 + H+ → 2Cr+++ + H2O + O2
No ajuste acima não há continuidade, pelo fato de estarem faltando os coeficientes de H+, H2O, O2.
Utilize x para H+ e calcule o valor de x através das cargas.
1Cr2O=7 + 3H2O2 + xH+ → 2Cr+++ + H2O + O2
-2 + x = 6
x = 6 + 2
x = 8
Agora que descobrimos o valor de x (8), vamos substituir x por 8:
1Cr2O=7 + 3H2O2 + 8H+ → 2Cr+++ + H2O + O2
Logo:
1Cr2O2-7 + 3H2O2 + 8H+ → 2Cr3+ + 7H2O + 3O2
1Cr2O=7 + 3H2O2 + H+ → 2Cr+++ + H2O + O2
No ajuste acima não há continuidade, pelo fato de estarem faltando os coeficientes de H+, H2O, O2.
Utilize x para H+ e calcule o valor de x através das cargas.
1Cr2O=7 + 3H2O2 + xH+ → 2Cr+++ + H2O + O2
-2 + x = 6
x = 6 + 2
x = 8
Agora que descobrimos o valor de x (8), vamos substituir x por 8:
1Cr2O=7 + 3H2O2 + 8H+ → 2Cr+++ + H2O + O2
Logo:
1Cr2O2-7 + 3H2O2 + 8H+ → 2Cr3+ + 7H2O + 3O2




















Nenhum comentário:
Postar um comentário