Antes de falarmos sobre os compostos inorgânicos, é importante lembrarmos que os orgânicos são constituídos por elementos químicos que contêm carbono. Já os inorgânicos são constituídos pelos outros elementos, como por exemplo, os compostos CO2, CO, Na2CO3, HCN entre outros.
Esses compostos inorgânicos estão organizados em quatro classes: ácidos, bases, sais e óxidos. Vejamos cada uma dessas classes:
2. Estudos dos ácidos
Para Arrhenius, ácidos são as substâncias que quando estão na água, são capazes de se ionizar, levando cátions para os íons hidrogênio (H+). Vejamos:
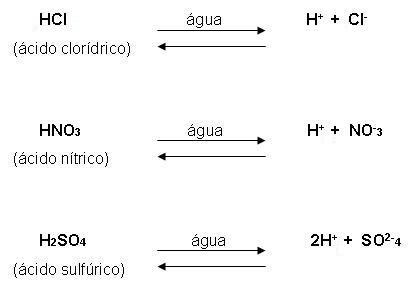
Os ácidos classificam-se em: hidrácidos que são aqueles que não contêm oxigênio, e em oxoácidos que são aqueles que contêm oxigênio.
3. Nomenclatura dos hidrácidos
Os hidrácidos são ácidos que não contêm oxigênio.
Existe uma regra necessária para a nomenclatura desses ácidos.

Por exemplo:
HCL – ácido clorídrico
HI – ácido iodídrico
H2S – ácido sulfídrico
H2Te – ácido telurídrico
Os ácidos estão presentes em diversos alimentos, por exemplo, no vinagre, no suco de limão, na coca cola, entre outros.

Os hidrácidos são ácidos que não contêm oxigênio.
Existe uma regra necessária para a nomenclatura desses ácidos.
Por exemplo:
HCL – ácido clorídrico
HI – ácido iodídrico
H2S – ácido sulfídrico
H2Te – ácido telurídrico
Os ácidos estão presentes em diversos alimentos, por exemplo, no vinagre, no suco de limão, na coca cola, entre outros.

4. nomenclatura dos oxoácidos
- Oxoácidos com elementos centrais não- metálicos
Os oxoácidos são ácidos que contêm oxigênio.
A princípio é necessário ter o conhecimento da tabela abaixo:
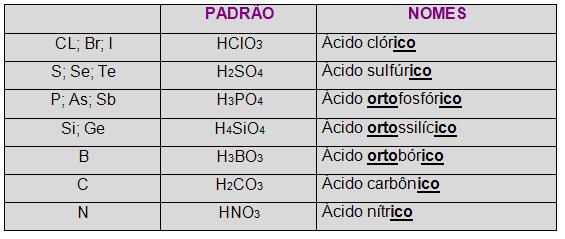
Observe que os ácidos-padrão em alguns casos têm o nome acompanhado por um prefixo (orto, grau máximo de hidratação).
Os demais ácidos nomeados decorrentes ao nome dos ácidos-padrão de cada uma das famílias, a organização é feita a partir de seis regras. Vejamos cada uma delas:
Regra 1 – terminação em ICO = padrão
*Maior número de oxidação.
Ex.: ácido telúrico- H2SO4
Substitui-se S por Te = H2TeO4
Regra 2 – terminação em OSO = padrão – um átomo de oxigênio.
*Menor número e oxidação.
Ex.: ácido bromoso- HClO3 Substitui-se Cl por Br, e retira-se um oxigênio = HBrO2
Regra 3 – inicia-se com HIPO,terminação em OSO = padrão – dois átomos de oxigênio.
*Menor de todos.
Ex.: ácido hipocloroso- HClO3
Retira-se 2 átomos de oxigênio = HClO
Regra 4 – inicia-se com PER terminação em ICO = padrão + um átomo de oxigênio.
*Maior de todos. Ex.: ácido perclórico- HClO3
Coloca-se um átomo de oxigênio = HClO4
Regra 5 – inicia-se com META = padrão – uma molécula de H2O.
*Grau mínimo de hidratação.
Ex.: ácido metafosfórico- H3PO4
Retira-se uma molécula de H2O = HPO3
Regra 6 – inicia-se com PIRO = 2x padrão – uma molécula de H2O.
*Grau intermediário de hidratação. Ex.: ácido pirofosfórico- H3PO4
O padrão é multiplicado por 2, retira-se uma molécula de H2O:
H3PO4 → (H3PO4) (x2) = H6P2O8 – H2O = H4P2O7
- Oxoácidos com elementos centrais metálicos


- Ácidos completos
Ácidos complexos são aqueles que contêm em sua fórmula íons complexos.
Por exemplo: ácido ferricianídrico:
5- Fórmulas estruturais e eletrônicas dos ácidos
- hidrácidos
Observe abaixo fórmula eletrônica de alguns dos hidrácidos:
Ácido fluorídrico: H – F Acido iodídrico: H – I Ácido clorídrico: H – Cl
- Ácidos orgânicos
Os ácidos orgânicos são ácidos carboxílicos, pelo fato de conterem a presença de carboxilas, que possuem hidrogênios que podem ser ionizados.
Carboxila
- Para escrever a fórmula estrutural de um oxoácido é necessário respeitar algumas regras, vejamos:
Regra número 1
É preciso escrever o símbolo do átomo central, por exemplo: Cl.
Regra número 2
É necessário ligar o átomo central aos grupos OH que forem ionizáveis (hidrogênios).
Regra número 3
É necessário ligar o átomo central aos hidrogênios não-ionizáveis se caso tiver hidrogênio não ionizável.
Regra número 4
Para que o octeto fique completo, é necessário que o átomo central esteja ligado aos átomos de oxigênio que sobrou, essa ligação deve ser por dupla ou dativa, de acordo com o que for necessário.
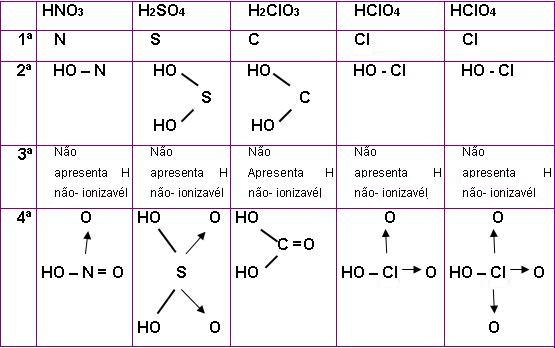
Para transformar as fórmulas estruturais em fórmula eletrônica é necessário apenas, trocar as ligações covalentes e dativas por pares de elétrons.
Particularidades
- Peroxiácidos
Peroxiácidos são todos os ácidos que em sua molécula contêm um grupo peróxi, ou seja, – O – O –.
Por exemplo:
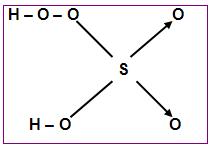
Ácido peroximonossulfúrico (H2SO5)
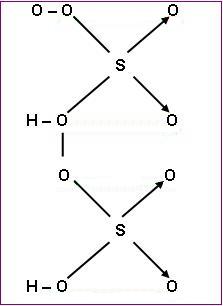
Ácido peroxidissulfúrico (H2S2O5)
- Tioácidos
É capaz de substituir um átomo de oxigênio por um átomo de enxofre.
Por exemplo:
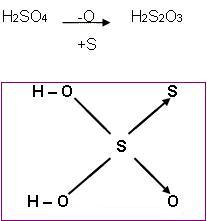
Ácido tiossulfúrico
6. Classificação dos ácidos
- À presença de oxigênio na molécula
Hidrácidos são todos os ácidos que não contêm oxigênio, por exemplo: HF, HCl.
Oxoácidos são todos os ácidos que possuem oxigênio em sua composição, por exemplo: H2SO4.
- número de hidrogênios ionizáveis
Todos os monoácidos que possuem um hidrogênio ionizável, por exemplo: HCl, HBr...
Todos os diácidos ou dipróticos possuem dois hidrogênios ionizáveis, por exemplo: H2SO4, H3PO3.
Todos os triácidos ou tripróticos possuem três hidrogênios ionizáveis, por exemplo: H3PO4, H3BO3.
Todos os tretrácidos ou tetrapróticos possuem quatro hidrogênios ionizáveis, por exemplo: H4P2O7.
- um poliácido é ionizado por fases, observe o exemplo abaixo:
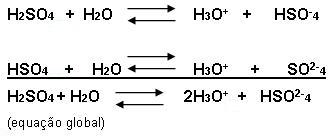
Observe agora de forma simplificado:
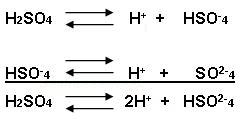
Hidrogênio ácido ou hidrogênio ionizável
Qualquer átomo de hidrogênio que tenha condições de se transformar em íons H+, é considerado hidrogênio ácido, porém, para esse átomo de hidrogênio se tornar ionizável é necessário estar ligado a um átomo eletronegativo.

O hidrogênio poderá ser ácido, quando estiver ligado a F, O, N, Cl, Br, I e S, e quando ele estiver ligado a carbono e fósforo não será ácido.
7. Estudo das bases
“base ou hidróxido é toda sustância que, dissolvida em água, se dissocia, fornecendo como ânion exclusivamente íons OH- (hidróxido)”
Definição de Arrhenius
Segundo Arrhenius, as bases devem possuir certas propriedades, como por exemplo: possuir sabor adstringente, conduzir eletricidade...
Por exemplo:
Nomenclatura
Se pensarmos em dar nome para uma base, através da fórmula geral
M (OH)x, temos:
M(OH)x - hidróxido de (nome de M)
Logo para cada fórmula abaixo temos:
NaOH → hidróxido de sódio
Ca(OH)2 → hidróxido de cálcio
Zn(OH)2 → hidróxido de zinco
Al(OH)3 → hidróxido de alumínio
NH4OH → hidróxido de amônio
Para indicar o maior e o menor número de oxidação, utilizam-se as terminações OSO e ICO:
CuOH → hidróxido cuproso
Cu (OH)2 → hidróxido cúprico
Fe (OH)2 → hidróxido ferroso
Fe (OH)3 → hidróxido férrico
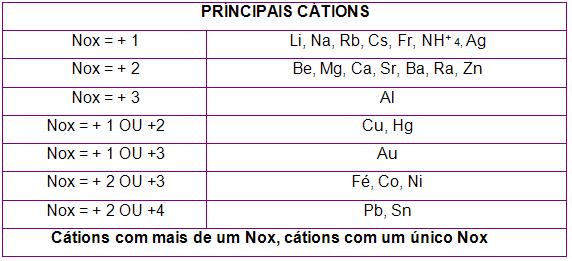
Tabela dos cátions
As bases são consideradas compostos iônicos, e quando estão em solução aquosa, elas se decompõem a partir disso se formam cátions diferentes de H+ e permanece o nome do metal, porém, se há dois números de oxidação acrescenta-se OSO ou ICO.
Vejamos alguns exemplos abaixo:
Na+ – cátion sódio
Cu1+ – cátion cobre I (cuproso)
Cu2+ – cátion cobre II (cúpriso)
Au1+ – cátion ouro I (auroso)
Au3+ – cátion ouro III (áurico)
Observe abaixo a tabela com os principais cátions

É importante lembrarmos que as bases compõem o Leite de magnésia, nos produtos de limpeza que são à base de amoníaco e também nos desentupidores. Lembrando que esses produtos citados fazem com que a fenolftaleína fique vermelha.
9. Fórmulas estruturais e eletrônicas das bases
Para criar uma fórmula eletrônica ou uma fórmula estrutural, devemos saber que:
- A ligação existente entre os átomos que contêm íon hidróxido será sempre covalente, sendo representada por:
- Quando houver ligações entre o cátion metálico e o íon hidróxido, essas ligações serão iônicas.
Observe os exemplos abaixo:
a) hidróxido de sódio
Observe os exemplos abaixo:
a) hidróxido de sódio
b) hidróxido de cálcio
Ocorre uma reação reversível, quando se coloca amônia (NH3) em água dando origem ao hidróxido de amônio.
Indicadores
Os indicadores são substâncias que reagem de forma diferente com um ácido, e com base, ou seja, há uma variação de cor. Vejamos os exemplos abaixo:
Fenolftaleína
Na presença de ácido: incolor
Na presença de base: rósea (vermelho)
Tornassol
Na presença de ácido: vermelho
Na presença de base: azul
Os indicadores são substâncias que reagem de forma diferente com um ácido, e com base, ou seja, há uma variação de cor. Vejamos os exemplos abaixo:
Fenolftaleína
Na presença de ácido: incolor
Na presença de base: rósea (vermelho)
Tornassol
Na presença de ácido: vermelho
Na presença de base: azul
10. Estudo dos sais
“Sal é todo composto que apresenta um cátion proveniente de uma base e um ânion proveniente de um ácido. Os sais são compostos iônicos.”
Definição de Arrhenius
Pode-se dizer que Na+Cl- é um sal, pois é formado por Na+ que é considerado um cátion resultante de uma base (NaOH), Cl- é um ânion resultante do ácido HCl, portanto, os sais surgem a partir da reação de uma base com um ácido, junto com a formação de água. Vejamos:
ÁCIDO + BASE → SAL + ÁGUA
HCl + NaOH → NaCl + H2O
Os sais sofrem dissociação, o que prova que eles são compostos iônicos. Portanto:
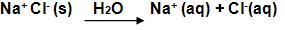
“Sal é todo composto que apresenta um cátion proveniente de uma base e um ânion proveniente de um ácido. Os sais são compostos iônicos.”
Definição de Arrhenius
Pode-se dizer que Na+Cl- é um sal, pois é formado por Na+ que é considerado um cátion resultante de uma base (NaOH), Cl- é um ânion resultante do ácido HCl, portanto, os sais surgem a partir da reação de uma base com um ácido, junto com a formação de água. Vejamos:
ÁCIDO + BASE → SAL + ÁGUA
HCl + NaOH → NaCl + H2O
Os sais sofrem dissociação, o que prova que eles são compostos iônicos. Portanto:
11. Reações de neutralização segundo a teoria de Arrhenius
É preciso considerar algumas informações sobre a reação de um ácido com uma base. Vejamos:
• Os ácidos covalentes que estão ionizados, conseqüentemente estão em solução aquosa, logo em uma reação de neutralização o HCl, irá aparecer da seguinte maneira: vejamos:
H+ Cl-
• As bases em solução aquosa ficam dissociadas, e são consideradas compostos iônicos, logo em uma reação o NaOH irá aparecer da seguinte maneira:
Na+ e OH-
• Os sais, compostos iônicos na presença de soluções aquosas fica dissociado, logo em uma reação o NaCl irá aparecer da seguinte maneira:
Na+ e Cl-
Observe abaixo a equação da reação de HCl e NaOH, considerando as informações anteriores:
H+ (aq) + Cl-(aq) + Na+ (aq) + OH-(aq) → Na+ (aq) + Cl-(aq) + H2O(l)
De forma mais simplificada:
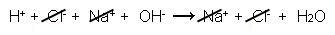
Vejamos agora outro exemplo com outra reação:
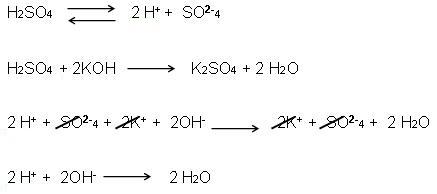
H2SO4 + KOH → KHSO4 + H2O
H+ + HSO-4 + K+ + OH- → K+ + HSO-4 + H2O
H+ + OH- → H2O
Agora observe a mesma reação, com a equação global, ou seja, a soma do H2SO4:
É preciso considerar algumas informações sobre a reação de um ácido com uma base. Vejamos:
• Os ácidos covalentes que estão ionizados, conseqüentemente estão em solução aquosa, logo em uma reação de neutralização o HCl, irá aparecer da seguinte maneira: vejamos:
H+ Cl-
• As bases em solução aquosa ficam dissociadas, e são consideradas compostos iônicos, logo em uma reação o NaOH irá aparecer da seguinte maneira:
Na+ e OH-
• Os sais, compostos iônicos na presença de soluções aquosas fica dissociado, logo em uma reação o NaCl irá aparecer da seguinte maneira:
Na+ e Cl-
Observe abaixo a equação da reação de HCl e NaOH, considerando as informações anteriores:
H+ (aq) + Cl-(aq) + Na+ (aq) + OH-(aq) → Na+ (aq) + Cl-(aq) + H2O(l)
De forma mais simplificada:
Vejamos agora outro exemplo com outra reação:
H2SO4 + KOH → KHSO4 + H2O
H+ + HSO-4 + K+ + OH- → K+ + HSO-4 + H2O
H+ + OH- → H2O
Agora observe a mesma reação, com a equação global, ou seja, a soma do H2SO4:

12. Nomenclatura dos sais
Da reação entre um ácido e uma base é que surge o sal.
HCl + NaOH → NaCl + H2O
NaCl = sal
É possível dizer que um sal é composto que surgiu de um ácido, trocando um ou mais hidrogênios ionizáveis por metais do grupo NH+4.
Vejamos a regra da nomenclatura dos sais:
(nome do ânion) de (nome do cátion)
Por exemplo:
Na+ Cl → cloreto de sódio
Na+ HCO-3 → bicarbonato
Nomenclatura dos ânions
Ânions originam-se a partir da ionização dos ácidos na água.
É necessário apenas trocar a terminação do nome, que provém do ácido:
Vejamos:
hidrácidos
Terminação do ácido – ídrico.
Terminação do ânion – eto.
Oxoáxidos
Terminação do ácido – oso, ico.
Terminação do ânion – ito, ato.
A nomenclatura dos ânions resultantes de ácidos que têm mais de um hidrogênio ionizável
Para as ionizações parciais dos ácidos que possuem mais de um hidrogênio ionizável, será necessário colocar ao início do nome, monoidrogeno, didrogenio etc., variando de acordo com o número de hidrogênios ionizáveis, ou ao final, a terminação monoácido, diácido etc.
Por exemplo:
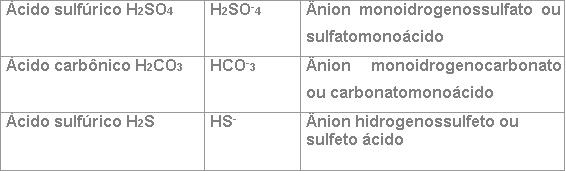
Inicia-se o nome por BI, quando o ânion possuir um hidrogênio ionizável que surgiu de um diácido. Por exemplo:

17. Fórmulas estruturais e eletrônicas dos sais
Sabemos que o sal é do resultado do ácido, pela substituição de um ou mais hidrogênios ionizáveis pelo grupo NH+4, ou por metais. Sabemos também que para conseguirmos a fórmula estrutural de um sal, é necessário iniciar a fórmula estrutural do ácido pelo qual ele surgiu.
Observe os exemplos abaixo:
a) sulfato de sódio – NA2SO4, ácido de origem – H2SO4
Sabemos que o sal é do resultado do ácido, pela substituição de um ou mais hidrogênios ionizáveis pelo grupo NH+4, ou por metais. Sabemos também que para conseguirmos a fórmula estrutural de um sal, é necessário iniciar a fórmula estrutural do ácido pelo qual ele surgiu.
Observe os exemplos abaixo:
a) sulfato de sódio – NA2SO4, ácido de origem – H2SO4
14. Fórmula do sal
É preciso escrever a fórmula do cátion, e escrever a fórmula do ânion, depois neutralizar a fórmula colocando a quantidade que for necessária de cátions e de ânions, dessa forma normalmente a carga é invertida e a fórmula fica neutralizada.
Vejamos os exemplos:
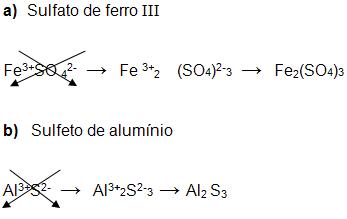
É preciso escrever a fórmula do cátion, e escrever a fórmula do ânion, depois neutralizar a fórmula colocando a quantidade que for necessária de cátions e de ânions, dessa forma normalmente a carga é invertida e a fórmula fica neutralizada.
Vejamos os exemplos:

15. Classificação dos sais
- sal normal

O sal normal é o resultado da reação de neutralização total do ácido com
a base, esse sal não possui ânion com hidrogênio ionizável, e também não possui grupo OH-, por exemplo, NaCl.
- hidrogenossal
O sal hidrogenossal é o resultado reação de neutralização parcial do ácido e total da base, possui ânion com um ou mais hidrogênios ionizáveis, não apresenta íons OH-, por exemplo, NaHCO3, KHSO4.
- hidroxissal
O sal hidroxissal é resultado da reação de neutralização parcial da base e total do ácido, não possui ânion com hidrogênios ionizáveis, mas apresenta grupo OH-, por exemplo, Mg(OH)Cl.
- sal duplo ou misto
O sal misto ou duplo possui no retículo cristalino, com mais de um cátion ou mais de um ânion.
Por exemplo: NaK (SO4)2- - sulfato duplo de sódio e potássio.
- sal hidratado

Sulfato cúprico azul
As moléculas de água que estão no retículo cristalino são denominadas “água de cristalização”, essas moléculas estão agarradas aos cátions e aos ânions.
Por exemplo: CuSO4 – sulfato de cobre II anidro (sólido branco).
- sal normal

O sal normal é o resultado da reação de neutralização total do ácido com
a base, esse sal não possui ânion com hidrogênio ionizável, e também não possui grupo OH-, por exemplo, NaCl.
- hidrogenossal
O sal hidrogenossal é o resultado reação de neutralização parcial do ácido e total da base, possui ânion com um ou mais hidrogênios ionizáveis, não apresenta íons OH-, por exemplo, NaHCO3, KHSO4.
- hidroxissal
O sal hidroxissal é resultado da reação de neutralização parcial da base e total do ácido, não possui ânion com hidrogênios ionizáveis, mas apresenta grupo OH-, por exemplo, Mg(OH)Cl.
- sal duplo ou misto
O sal misto ou duplo possui no retículo cristalino, com mais de um cátion ou mais de um ânion.
Por exemplo: NaK (SO4)2- - sulfato duplo de sódio e potássio.
- sal hidratado

Sulfato cúprico azul
As moléculas de água que estão no retículo cristalino são denominadas “água de cristalização”, essas moléculas estão agarradas aos cátions e aos ânions.
Por exemplo: CuSO4 – sulfato de cobre II anidro (sólido branco).
Como fazer as equações de neutralização
Para fazer as equações de neutralização é necessário seguir algumas regras:
Regra de número 1 – é necessário ionizar o ácido e descobrir o ânion.
Regra de número 2 – é necessária a dissociação da base, descobrindo o cátion.
Regra de número 3 – é necessário fazer a fórmula do sal.
Regra de número 4 – e por último, escrever a equação onde o sal e a água fiquem na condição de produto, acertando os coeficientes.
- neutralização total do ácido e da base, formando sais normais.
Observe agora a neutralização total de ácidos de bases, formando sais normais, a partir das regras.
Ácido fósforo + hidróxido de sódio →
Regra de número 1
Ácido fosfórico → H3PO4 → PO3-4 (fosfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3 Sal: NaPO3-4 → Na3PO4
Regra de número 4 – equação da reação
H3PO4(ácido fosfórico) + 3NaOH (hidróxido de sódio) → Na3PO4(fosfato de sódio) + 3 H2O
Ácido nítrico + hidróxido de cálcio →
Regra de número 1
Ácido nítrico → HNO3 → NO-3 (nitrato)
Regra de número 2
Hidróxido de cálcio → Ca (OH)2 → Ca2+ (cátion cálcio)
Regra de número 3
Sal: Ca2-NO-3 → Ca (NO3)2
Regra de número 4 – equação da reação
2 HNO3(ácido nítrico) + Ca(OH)2(hidróxido de cálcio)→ Ca(NO3)2(fosfato de sódio) + 2 H2O
Ácido clorídrico + hidróxido de ferro III →
Regra de número 1
Ácido clorídrico → HCl → Cl- (cloreto)
Regra de número 2
Hidróxido de ferro III → Fe (OH)3 → Fe3+ (cátion ferro III)
Regra de número 3
Sal: Fe3+Cl- → FeCl3
Regra de número 4 – equação da reação
2 HCl(ácido clorídrico) + Fe(OH)3(hidróxido de ferro III)→ FeCl3(cloreto de ferro III) + 3 H2O
Ácido sulfúrico + hidróxido de potássio →
Regra de número 1
Ácido sulfúrico → H2SO4 → SO2-4 (sulfato)
Regra de número 2
Hidróxido de potássio → KOH → K+ (cátion potássio)
Regra de número 3 Sal: K+SO2-4 → K2SO4
Regra de número 4 – equação da reação
H2SO4(ácido sulfúrico) + 2 KOH (hidróxido de potássio)→ K2SO4(sulfato de potássio) + 2 H2O
Ácido fosforoso + hidróxido de sódio →
Regra de número 1 Ácido fosforoso → H3PO3 → PO2-3 (fosfito)
Regra de número 2 Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+HPO2-3 → Na2HPO3
Regra de número 4 – equação da reação
H3PO3(ácido fosforoso) + 2 NaOH(hidróxido de sódio)→ Na2HPO3(fosfito de sódio) + 2 H2O
Ácido hipofosforoso + hidróxido de sódio →
Regra de número 1 Ácido hipofosforoso → H3PO2 → PO-2 (hipofosfito)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3 Sal: Na+H2PO-2 → Na2HPO2
Regra de número 4 – equação da reação
H3PO2(ácido hipofosforoso) + NaOH(hidróxido de sódio)→ Na2HPO3(hipofosfito de sódio) + H2O.
- neutralização parcial do ácido e total da base, formando hidrogenossal
Ácido sulfúrico + hidróxido de sódio →
Regra de número 1
Ácido sulfúrico → H3PO4 → HSO-4 (bissulfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+SHO-4 → NaHPO4
Regra de número 4 – equação da reação
H2SO4(ácido sulfúrico) + NaOH(hidróxido de sódio)→ Na+HSO4(hidrogenossulfato de sódio ou sulfatoácido de sódio ou bissulfato de sódio) + H2O.
Ácido fosfórico + hidróxido de sódio →
Regra de número 1
Ácido fosfórico → H3PO4 → H2PO1-4 (diidrogenofosfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+H2PO-4 → NaH2PO4
Regra de número 4 – equação da reação
H2PO4(ácido fosfórico) + não H(hidróxido de sódio)→ Na+H2PO-4(diidrogenofosfato de sódio ou fosfatodiácido de sódio) + H2O.
Ácido fosfórico + hidróxido de sódio →
Regra de número 1
Ácido fosfórico → H3PO4 → H2PO2-4 (monodrogenofosfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+ (HPO4)2- → Na2HPO4
Regra de número 4 – equação da reação
H2PO4(ácido fosfórico) + 2 NaOH(hidróxido de sódio)→ Na+H2PO-4(monodrogenofosfato de sódio ou fosfatomonoácido de sódio) + 2 H2O.
- neutralização parcial da base e total do ácido, formando hidroxissal
Ácido clorídrico + hidróxido de magnésio →
Regra de número 1 Ácido clorídrico → HCl → Cl- (cloreto)
Regra de número 2
Hidróxido de magnésio → Mg(OH)2 → (MgOH)+ (hidroximagnésio)
Regra de número 3
Sal: (MgOH)+ (Cl)- → Mg2OHCl
Regra de número 4 – equação da reação
HCl + 2 Mg(OH)2 → MgOHCl (hidroxicloreto de magnésio ou cloretobásico de magnésio) + 2 H2O.
Para fazer as equações de neutralização é necessário seguir algumas regras:
Regra de número 1 – é necessário ionizar o ácido e descobrir o ânion.
Regra de número 2 – é necessária a dissociação da base, descobrindo o cátion.
Regra de número 3 – é necessário fazer a fórmula do sal.
Regra de número 4 – e por último, escrever a equação onde o sal e a água fiquem na condição de produto, acertando os coeficientes.
- neutralização total do ácido e da base, formando sais normais.
Observe agora a neutralização total de ácidos de bases, formando sais normais, a partir das regras.
Ácido fósforo + hidróxido de sódio →
Regra de número 1
Ácido fosfórico → H3PO4 → PO3-4 (fosfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3 Sal: NaPO3-4 → Na3PO4
Regra de número 4 – equação da reação
H3PO4(ácido fosfórico) + 3NaOH (hidróxido de sódio) → Na3PO4(fosfato de sódio) + 3 H2O
Ácido nítrico + hidróxido de cálcio →
Regra de número 1
Ácido nítrico → HNO3 → NO-3 (nitrato)
Regra de número 2
Hidróxido de cálcio → Ca (OH)2 → Ca2+ (cátion cálcio)
Regra de número 3
Sal: Ca2-NO-3 → Ca (NO3)2
Regra de número 4 – equação da reação
2 HNO3(ácido nítrico) + Ca(OH)2(hidróxido de cálcio)→ Ca(NO3)2(fosfato de sódio) + 2 H2O
Ácido clorídrico + hidróxido de ferro III →
Regra de número 1
Ácido clorídrico → HCl → Cl- (cloreto)
Regra de número 2
Hidróxido de ferro III → Fe (OH)3 → Fe3+ (cátion ferro III)
Regra de número 3
Sal: Fe3+Cl- → FeCl3
Regra de número 4 – equação da reação
2 HCl(ácido clorídrico) + Fe(OH)3(hidróxido de ferro III)→ FeCl3(cloreto de ferro III) + 3 H2O
Ácido sulfúrico + hidróxido de potássio →
Regra de número 1
Ácido sulfúrico → H2SO4 → SO2-4 (sulfato)
Regra de número 2
Hidróxido de potássio → KOH → K+ (cátion potássio)
Regra de número 3 Sal: K+SO2-4 → K2SO4
Regra de número 4 – equação da reação
H2SO4(ácido sulfúrico) + 2 KOH (hidróxido de potássio)→ K2SO4(sulfato de potássio) + 2 H2O
Ácido fosforoso + hidróxido de sódio →
Regra de número 1 Ácido fosforoso → H3PO3 → PO2-3 (fosfito)
Regra de número 2 Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+HPO2-3 → Na2HPO3
Regra de número 4 – equação da reação
H3PO3(ácido fosforoso) + 2 NaOH(hidróxido de sódio)→ Na2HPO3(fosfito de sódio) + 2 H2O
Ácido hipofosforoso + hidróxido de sódio →
Regra de número 1 Ácido hipofosforoso → H3PO2 → PO-2 (hipofosfito)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3 Sal: Na+H2PO-2 → Na2HPO2
Regra de número 4 – equação da reação
H3PO2(ácido hipofosforoso) + NaOH(hidróxido de sódio)→ Na2HPO3(hipofosfito de sódio) + H2O.
- neutralização parcial do ácido e total da base, formando hidrogenossal
Ácido sulfúrico + hidróxido de sódio →
Regra de número 1
Ácido sulfúrico → H3PO4 → HSO-4 (bissulfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+SHO-4 → NaHPO4
Regra de número 4 – equação da reação
H2SO4(ácido sulfúrico) + NaOH(hidróxido de sódio)→ Na+HSO4(hidrogenossulfato de sódio ou sulfatoácido de sódio ou bissulfato de sódio) + H2O.
Ácido fosfórico + hidróxido de sódio →
Regra de número 1
Ácido fosfórico → H3PO4 → H2PO1-4 (diidrogenofosfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+H2PO-4 → NaH2PO4
Regra de número 4 – equação da reação
H2PO4(ácido fosfórico) + não H(hidróxido de sódio)→ Na+H2PO-4(diidrogenofosfato de sódio ou fosfatodiácido de sódio) + H2O.
Ácido fosfórico + hidróxido de sódio →
Regra de número 1
Ácido fosfórico → H3PO4 → H2PO2-4 (monodrogenofosfato)
Regra de número 2
Hidróxido de sódio → NaOH → Na+ (cátion sódio)
Regra de número 3
Sal: Na+ (HPO4)2- → Na2HPO4
Regra de número 4 – equação da reação
H2PO4(ácido fosfórico) + 2 NaOH(hidróxido de sódio)→ Na+H2PO-4(monodrogenofosfato de sódio ou fosfatomonoácido de sódio) + 2 H2O.
- neutralização parcial da base e total do ácido, formando hidroxissal
Ácido clorídrico + hidróxido de magnésio →
Regra de número 1 Ácido clorídrico → HCl → Cl- (cloreto)
Regra de número 2
Hidróxido de magnésio → Mg(OH)2 → (MgOH)+ (hidroximagnésio)
Regra de número 3
Sal: (MgOH)+ (Cl)- → Mg2OHCl
Regra de número 4 – equação da reação
HCl + 2 Mg(OH)2 → MgOHCl (hidroxicloreto de magnésio ou cloretobásico de magnésio) + 2 H2O.







Nenhum comentário:
Postar um comentário