O flúor é um elemento em que não se pode obter um óxido, pois ele é mais eletronegativo que o oxigênio, é importante saber que OF2 não é um óxido, mas é um difluoreto de oxigênio.
Por exemplo:
CO2, CO, SO2, SO3, NO, N2O, Cl2O7, Na2O, K2O, BaO, BaO2.
2. Nome dos óxidos
1) Existe uma regra geral para óxidos ExOy
mono mono
di + ÓXIDO DE di + NOME DE E
tri tri
ect. etc.
Os valores de x e y na fórmula do óxido são indicados pelos prefixos da 1ª coluna (mono, di, tri, etc.), os prefixos da 2ª coluna em geral não é omitido.
Observe os exemplos:
SO3 – trióxido de monoenxofre ou trióxido de enxofre.
N2O3 – trióxido de dinitrogênio
Fe3O4 – tetróxido de triferro (magnetita)
CO2 – dióxido de monocarbono ou monóxido de carbono
Cl2O7 – heptóxido de dicloro
2) Esta regra diz respeito a óxidos de metais que possuem um Nox, e o oxigênio possui Nox = -2.
Para essa regra utiliza-se:
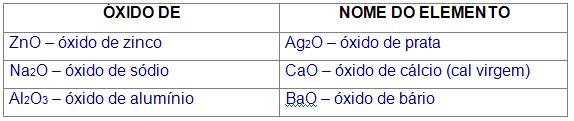
3) Esta regra diz respeito a óxidos de metais que possuem mais de um Nox, e o oxigênio possui Nox = -2.
Para essa regra utiliza-se a nomenclatura de Stock:

É permitida também, a utilização das terminações OSO, no caso de óxidos de menor Nox, e ICO para o óxido de maior Nox, isso nesta situação:
2+
FeO – óxido ferroso
3+
Fe2O3 – óxido ferroso
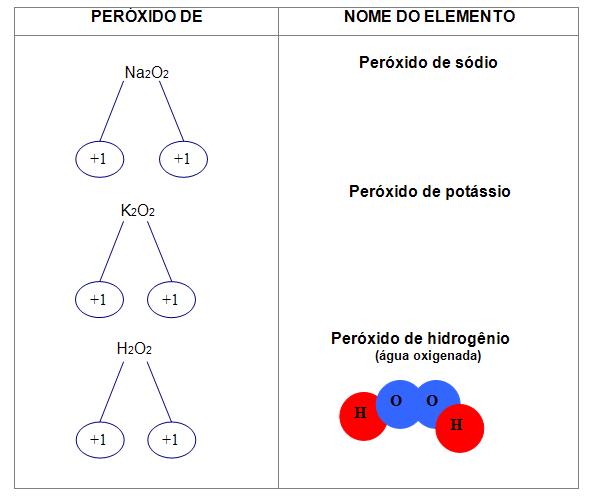
4) Esta regra diz respeito a óxidos no qual o oxigênio possui Nox = -1.
Os peróxidos estão presentes nesses óxidos, que contêm a ligação (– O – O –)
Para essa regra utiliza-se:
1) Existe uma regra geral para óxidos ExOy
mono mono
di + ÓXIDO DE di + NOME DE E
tri tri
ect. etc.
Os valores de x e y na fórmula do óxido são indicados pelos prefixos da 1ª coluna (mono, di, tri, etc.), os prefixos da 2ª coluna em geral não é omitido.
Observe os exemplos:
SO3 – trióxido de monoenxofre ou trióxido de enxofre.
N2O3 – trióxido de dinitrogênio
Fe3O4 – tetróxido de triferro (magnetita)
CO2 – dióxido de monocarbono ou monóxido de carbono
Cl2O7 – heptóxido de dicloro
2) Esta regra diz respeito a óxidos de metais que possuem um Nox, e o oxigênio possui Nox = -2.
Para essa regra utiliza-se:

3) Esta regra diz respeito a óxidos de metais que possuem mais de um Nox, e o oxigênio possui Nox = -2.
Para essa regra utiliza-se a nomenclatura de Stock:

É permitida também, a utilização das terminações OSO, no caso de óxidos de menor Nox, e ICO para o óxido de maior Nox, isso nesta situação:
2+
FeO – óxido ferroso
3+
Fe2O3 – óxido ferroso
4) Esta regra diz respeito a óxidos no qual o oxigênio possui Nox = -1.
Os peróxidos estão presentes nesses óxidos, que contêm a ligação (– O – O –)
Para essa regra utiliza-se:

Óxidos covalentes ou moleculares
Ligações covalentes – elementos que estão ligados ao oxigênio com muita eletronegatividade; os óxidos moleculares os não-metais e semimetais.
Por exemplo:
Abaixo temos a classificação dos óxidos, no que diz respeito ao comportamento das reações:
- básicos
- ácidos
- neutros
- anfóteros
- duplos ou salinos ou mistos
- superiores: perióxidos, superóxidos, bióxidos.
5. Óxidos básicos
Para que um óxido seja considerado básico, ao reagir com um ácido, ele deve resultar em água e sal.
ÓXIDO BÁSICO + ÁCIDO → SAL + ÁGUA
São baixos os números de oxidação dos metais (alcalinos, alcalinoterrosos e os outros metais) que constituem os ácidos básicos.
Por exemplo:
Na2O, K2O, CaO, CuC, Cu2O, Ag2O e MnO
CaO + H2SO4 → CaSO4 + H2O
Surgi base, quando ocorre uma reação entre os óxidos dos metais alcalinoterrosos e alcalinos terrosos com a água.
K2O + HOH → 2 KOH (solúvel)
Se tratando dos outros óxidos, podemos dizer que ele não reage com a água, pelo fato do hidróxido correspondente ser insolúvel, criando certa película que não deixa a reação acontecer.
Para dissociar os metais muito nobres: Ag, Au, Hg, é preciso aquecê-los.
Por exemplo:
↑
2 HgO → 2Hg + O2
Abaixo, observe alguns nomes particulares.
CaO – cal virgem ou cal viva
Solução de Cal (OH)2 – água de sal
Suspensão de Mg (OH)2 – leite de magnésia
Para que um óxido seja considerado básico, ao reagir com um ácido, ele deve resultar em água e sal.
ÓXIDO BÁSICO + ÁCIDO → SAL + ÁGUA
São baixos os números de oxidação dos metais (alcalinos, alcalinoterrosos e os outros metais) que constituem os ácidos básicos.
Por exemplo:
Na2O, K2O, CaO, CuC, Cu2O, Ag2O e MnO
CaO + H2SO4 → CaSO4 + H2O
Surgi base, quando ocorre uma reação entre os óxidos dos metais alcalinoterrosos e alcalinos terrosos com a água.
K2O + HOH → 2 KOH (solúvel)
Se tratando dos outros óxidos, podemos dizer que ele não reage com a água, pelo fato do hidróxido correspondente ser insolúvel, criando certa película que não deixa a reação acontecer.
Para dissociar os metais muito nobres: Ag, Au, Hg, é preciso aquecê-los.
Por exemplo:
↑
2 HgO → 2Hg + O2
Abaixo, observe alguns nomes particulares.
CaO – cal virgem ou cal viva
Solução de Cal (OH)2 – água de sal
Suspensão de Mg (OH)2 – leite de magnésia
6. Óxidos ácidos
Para que um óxido seja considerado ácido, ao reagir com uma base, ele deve resultar em água e sal.
ÓXIDO ÁCIDO + BASE → SAL + ÁGUA
Os números de oxidação dos não-metais e alguns outros metais que formam os óxidos ácidos são bem altos.
Por exemplo:
N2O5, N2O3, SO3, P4O10, CO2, Cl2O7, MnO7 e CrO3.
CO2 + Ca(OH)4 → CaCO3 + H2O
Essa denominação de anidrido de ácido para óxido de ácido é conseqüência do fato de que quase todos os óxidos ácidos conseguem reagir com água, fazendo surgir o ácido correspondente.
Observe abaixo os exemplos:
6+ 6+
SO3 + H2O → H2SO4
Anidrido sulfúrico ácido sulfúrico
Só é possível que SiO2 (sílica) reaja com base, pois não a reação não ocorrerá em água.
↑
SiO2 + 2NaOH → Na2SiO3 + H2O
∆ metassilicato de sódio
Os anidridos mistos ou duplos surgem do resultado da mistura de dois ácidos possíveis de reagir com a água, porém não são todos eles, são apenas: NO2, ClO2, Cl2O6.
4+ 3+ 5+
2NO2 + H2O → HNO2 + HNO3
Anidrido nitroso-nítrico
6+ 5+ 7+
Cl2O6 + H2O → HClO3 + HClO4
Anidrido clórico-perclórico
O grau de hidratação é responsável pelo surgimento de mais de um ácido, resultado da reação de alguns anidridos com água.
5+ 5+
P4O10 + 6H2O → 4H3PO4 (ácido ortofosfórico)
5+
4O10 + 2H2O → 4HPO3 (ácido metafosfórico)
Anidrido fosfórico
É possível que ocorra uma reação entre os óxidos ácidos com os óxidos básicos, o resultado é a formação do sal.
ÓXIDO ÁCIDO + ÓXIDO BÁSICO → SAL
CO2 + CaO → CaCO3
carbonato de cálcio
7. Óxidos neutros ou indiferentes
Não é possível que ocorra a reação, nem com base, água, ácido ou base, isso ocorre nos ácidos neutros.
Exemplo:
CO, NO e N2O (gás hilário)
Não é possível que ocorra a reação, nem com base, água, ácido ou base, isso ocorre nos ácidos neutros.
Exemplo:
CO, NO e N2O (gás hilário)
8. Óxidos anfóteros
Ocorre que os óxidos anfóteros variam seu comportamento com a presença de bases, ácido forte.
Quando próximo de base forte, se comporta como óxido de ácido.
Quando próximo de ácido forte, se comporta como óxido base.
ÓXIDO ANFÓTERO + ÁCIDO → SAL + ÁGUA
ÓXIDO ANFÓTERO + BASE → SAL COMPLEXO
Exemplos:
ZnO, Al2O3, PbO, SnO, SnO2, As2O3 e As2O5
- caso o número de oxidação seja baixo, o óxido anfótero será mais básico do que ácido.
Por exemplo: SnO
- caso o número de oxidação seja alto, o óxido anfótero será mais ácido do que básico.
Por exemplo: SnO2
Observe agora outros exemplos:
a) Com ácido
ZnO + 2HCl → ZnCl2 + H2O
b) Com base forte
ZnO + 2NaOH → Na2[Zn(OH)4]
Tetraidroxizincato de sódio
Ocorre perda de água no sal complexo, pelo aquecimento.
Na2[Zn (OH)4] → Na2ZnO2 + 2H2O
Sincato de sódio
Ocorre liberação de hidrogênio nos metais zinco e alumínio, isso acontece quando eles reagem com solução de base forte.
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Ocorre que os óxidos anfóteros variam seu comportamento com a presença de bases, ácido forte.
Quando próximo de base forte, se comporta como óxido de ácido.
Quando próximo de ácido forte, se comporta como óxido base.
ÓXIDO ANFÓTERO + ÁCIDO → SAL + ÁGUA
ÓXIDO ANFÓTERO + BASE → SAL COMPLEXO
Exemplos:
ZnO, Al2O3, PbO, SnO, SnO2, As2O3 e As2O5
- caso o número de oxidação seja baixo, o óxido anfótero será mais básico do que ácido.
Por exemplo: SnO
- caso o número de oxidação seja alto, o óxido anfótero será mais ácido do que básico.
Por exemplo: SnO2
Observe agora outros exemplos:
a) Com ácido
ZnO + 2HCl → ZnCl2 + H2O
b) Com base forte
ZnO + 2NaOH → Na2[Zn(OH)4]
Tetraidroxizincato de sódio
Ocorre perda de água no sal complexo, pelo aquecimento.
Na2[Zn (OH)4] → Na2ZnO2 + 2H2O
Sincato de sódio
Ocorre liberação de hidrogênio nos metais zinco e alumínio, isso acontece quando eles reagem com solução de base forte.
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
9. Óxidos duplos ou salinos ou mistos
Óxido no qual o metal possui dois números de oxidação, por isso são denominados óxidos duplos.
Por exemplo:
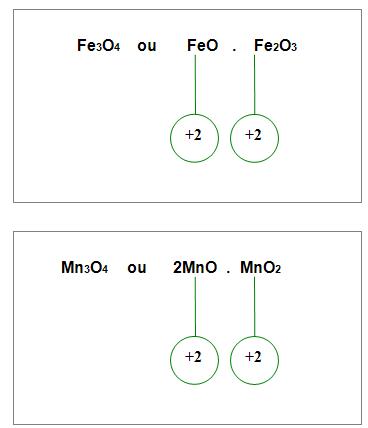
Óxido no qual o metal possui dois números de oxidação, por isso são denominados óxidos duplos.
Por exemplo:

Óxidos superiores Esses óxidos a partir de uma reação com oxoácidos geram sal e oxigênio, e/ou H2O2.
Observe agora como são classificados os óxidos superiores.
Peróxidos
A reação com o ácido resulta em sal e H2O2.
A ligação [– O – O–] está presente nos peróxidos, neste caso o oxigênio aparece com o número de oxidação igual a -1.
H2O2 (H – O – O – H), é um peróxido que possui extrema importância, a formação de metais alcalinos e alcalinoterrosos é a dos demais peróxidos.
Por exemplo:
K2O2, K11+[O – O]2- K1+ – peróxido de potássio
Na2O2 – peróxido de sódio
BaO2 – peróxido de bário
CaO2 – peróxido de cálcio
BaO2 + H2SO4 → BaSO4↓ + H2O2
Superóxido (hiperóxido)
Os superóxidos ou hiperóxidos quando reagem com ácido fazem surgir sal, H2O2 e O2, o oxigênio presente no ânion O1-2, que compõe os superóxidos, apresentam número de oxidação médio igual a -1/2. Os metais alcalinos e alcalinoterrosos fazem parte da composição dos peróxidos.
Por exemplo:
K2O2 – peróxido de potássio
NaO2 – peróxido de sódio
Ba(O2)2 – peróxido de bário
↑
Ba(O2)2 + H2SO4 → BaSO4↓ + H2O2 + O2
Bióxidos
Os bióxidos formam sal, água e oxigênio quando reage com oxoácido, o número de oxidação do oxigênio nos bióxidos é igual a -2.
Por exemplo:
4+ 2-
MnO2 – bióxido de manganês
PbO2 – bióxido de chumbo
↑
2MnO2 + 2H2SO4 → 2MnSO4 + 2H2O + O2
11. Compostos binários hidrogenados Os compostos binários hidrogenados possuem em sua composição apenas dois elementos, no qual um desses elementos é o hidrogênio.
Por exemplo:
NaH, CaH2, HCl, H2S
Os compostos podem tanto ser iônicos quanto moleculares.
- compostos binários hidrogenados iônicos
Hidretos metálicos
+ –
K H – hidretos de potássio
2+ –
Ca H2 – hidretos de cálcio
Liberam gás hidrogênio quando reagem com água.
NaH + HOH → NaOH + H2
Os hidretos metálicos são utilizados para inflar botes salva-vidas e balões, por essa reação que ocorre e faz com eles sejam fontes de H2.
- compostos binários hidrogenados moleculares
Os compostos são de hidrogênios junto com não metais.
HF – fluoreto de hidrogênio
H2S – sulfato de hidrogênio
NH3 – nitreto de hidrogênio (amônio)
12. Poluição e chuva ácida
Sem a poluição a chuva já tem seu grau de acidez
Nitrogênio (N2): 78%, oxigênio (O2): 21%, argônio (Ar), 0,9%, gás carbônico ou dióxido, (CO2), 0,03%, esta é a composição do ar atmosférico, quando não está poluído e seco.
A chuva de uma área em que o ar não está poluído e que não ocorrem relâmpagos é pouco ácida, pois o carbono está presente na composição do ar.
Ocorre que, quando o dióxido de carbono reage com a água da chuva, resultando na formação do ácido carbônico (H2CO3), que é ionizado, de forma bem fraca.
H2O + CO2 → H2CO3 → H+ + HCO-3
A chuva com poluição é fortemente ácida
O monóxido de carbono (CO) é produzido por queima de combustível fóssil, e também o gás carbônico (CO2), porém, o monóxido de carbono no sangue pega o lugar do oxigênio na hemoglobina.
C + O2 → CO2
C + 1/2O2 → CO
O dióxido de enxofre (SO2) produzido quando o combustível é queimado se torna extremamente venenoso. A chuva se torna muito ácida quando em um espaço de tempo o dióxido de enxofre reage com mais oxigênio, resultando no que chamamos de trióxido de enxofre, é constituído com a água da chuva o ácido sulfúrico, que é ionizado.
S + O2 → SO2
SO2 + 1/2O2 → SO3
SO3 + H2O → H2SO4
13. Efeito estufa O efeito estufa pé considerado um fenômeno, que foi diretamente causado pela concentração do dióxido de carbono, óxido nitroso, metano e clorofluorcabonos.
Cria-se uma camada na atmosfera que faz com que os raios solares passe e absorva muito calor da superfície terrestre.
São muitos os fatores que atualmente está contribuindo com a concentração de CO2 na atmosfera, por exemplo, o desmatamento por queimadas, o consumo excessivo de combustíveis etc.
O resultado desse aumento de CO2 por esses fatores é o aumento de aquecimento global, que está acelerado nos últimos anos.
http://www.colegioweb.com.br/quimica/efeito-estufa.html


Nenhum comentário:
Postar um comentário