Sabe-se que a pilha surgiu por volta de 1800. A descoberta de alguns químicos foi que certa solução conduzia corrente elétrica, chegaram a essa conclusão da seguinte forma: com dois fios condutores que estavam ligados aos pólos de uma pilha em uma solução aquosa de NaCl (sal de cozinha), os condutores também estavam em contato com a solução, e uma lâmpada foi colocada no circuito, e acendeu, testaram uma solução de sacarose, nesta a lâmpada não acendeu, ou seja, essa solução não conduz corrente elétrica, isso ocorre pelo fato de que nesta solução as moléculas- são eletricamente neutras.
2. Soluções não-eletrolíticas ou moleculares
São denominadas soluções não-eletrolíticas ou moleculares, as soluções aquosas do açúcar, que não conduzem energia, por exemplo: solução de açúcar, álcool, éter, os compostos destas são denominados não-eletrólitos.
São denominadas soluções não-eletrolíticas ou moleculares, as soluções aquosas do açúcar, que não conduzem energia, por exemplo: solução de açúcar, álcool, éter, os compostos destas são denominados não-eletrólitos.
3. Soluções eletrolíticas
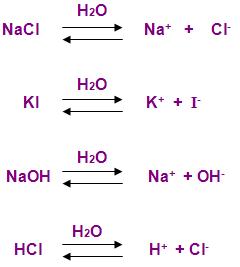
São denominadas soluções eletrolíticas, as que conduzem energia elétrica, soluções aquosas de NaCl, KI, NaOH, HCl entre outras, os compostos destas soluções são denominados não-eletrólitos, e os compostos NaCl, KI, NaOH, HCl são denominados eletrólitos.
Essas soluções (NaCl,KI,NaOH, HCl) são condutores de energia pelo fato de se transformarem ao serem colocadas na água.
Svante August Arrhenius
 Químico Suéco, nasceu em 1859, e morreu em 1927.
Químico Suéco, nasceu em 1859, e morreu em 1927.
A Teoria da Dissociação Eletrolítica do químico sueco Arrhenius, diz respeito ao fato das transformações poderem voltar ao estado anterior em sentido oposto, ou seja elas são consideradas reversíveis, pois elas ocorrem nos dois sentidos, sendo assim equacionadas com dupla seta, sendo uma contraria da outra.
Observe:
São denominadas soluções eletrolíticas, as que conduzem energia elétrica, soluções aquosas de NaCl, KI, NaOH, HCl entre outras, os compostos destas soluções são denominados não-eletrólitos, e os compostos NaCl, KI, NaOH, HCl são denominados eletrólitos.
Essas soluções (NaCl,KI,NaOH, HCl) são condutores de energia pelo fato de se transformarem ao serem colocadas na água.
Svante August Arrhenius
 Químico Suéco, nasceu em 1859, e morreu em 1927.
Químico Suéco, nasceu em 1859, e morreu em 1927.A Teoria da Dissociação Eletrolítica do químico sueco Arrhenius, diz respeito ao fato das transformações poderem voltar ao estado anterior em sentido oposto, ou seja elas são consideradas reversíveis, pois elas ocorrem nos dois sentidos, sendo assim equacionadas com dupla seta, sendo uma contraria da outra.
Observe:

4. Os eletrólitos
Os eletrólitos são compostos que quando são colocados em contato com a água, originam soluções eletrolíticas, podendo ser tanto de natureza covalente, como de natureza iônica.
Eletrólitos de natureza iônica
Sabe-se que em condições ambientais os compostos iônicos estão no estado sólido, nos eletrólitos eles constituem uma espécie de retículo, ficando retidos nesses retículos, nesse estado não é possível que conduzam corrente elétricas.
Ao ser colocado o eletrólito em contato com a água, esse retículo irá se quebrar.
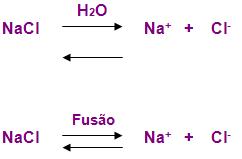
Dissociação iônica: é o processo de separação dos íons.
Eletrólitos covalentes (moleculares)
É a reação entre os compostos covalentes quando colocados na água provocam o surgimento de íons que fazem com que a solução seja condutora de corrente elétrica.
Por exemplo:
Coloca-se HCl na água, acontecerá uma reação. Vejamos a ilustração abaixo:
Força dos ácidos – grau de ionização
A ionização é reversível, e por isso utiliza-se duas setas na reação.
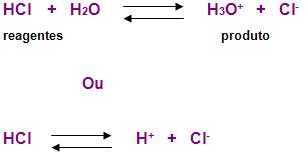
Alguns ácidos realizam a ionização quase no final do processo, podemos reparar que muitas moléculas se transformaram em íons, isso é o que ocorre com o HCl, desta forma representaremos a ionização com as setas de tamanhos diferentes, a maior no sentido dos reagentes para o produto. Observe:
Isso ocorre também no ácido acético. Vejamos:
A ionização é reversível, e por isso utiliza-se duas setas na reação.

Alguns ácidos realizam a ionização quase no final do processo, podemos reparar que muitas moléculas se transformaram em íons, isso é o que ocorre com o HCl, desta forma representaremos a ionização com as setas de tamanhos diferentes, a maior no sentido dos reagentes para o produto. Observe:
Isso ocorre também no ácido acético. Vejamos:
11. Grau de ionização (α)
Observe o cálculo do valor numérico do grau de ionização α de um ácido a partir da seguinte reação:

O valor do grau de ionização de HCl – COOH, irá ter o seguinte valor :
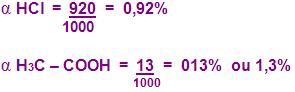
Observe o cálculo do valor numérico do grau de ionização α de um ácido a partir da seguinte reação:
O valor do grau de ionização de HCl – COOH, irá ter o seguinte valor :
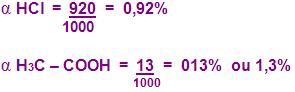
12. Classificação dos ácidos quanto à força
A força dos ácidos é medida pelo grau de ionização. Os ácidos são divididos entre forte e fraco, por exemplo: HCl é um ácido forte e é um eletrólito forte e H3C – COOH é ácido fraco e é um eletrólito fraco.
Observe a tabela:
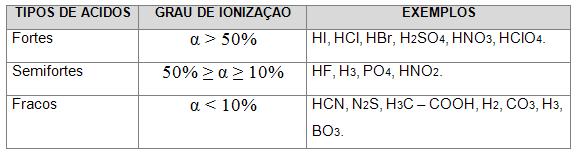
É possível classificar os oxoácidos em fortes, fraco ou semifortes, através da seguinte regra:

O H2CO3 é uma exceção, ele é uma ácido fraco pois como sabemos (3 – 2 = 1) a decomposição resulta em H2O e CO2, o que prova que ele realmente é um ácido fraco.
H2CO3 → H2O + CO2
Essa regra não pode ser aplicada aos hidrácidos.
É importante lembrar que:
HCl, HBr, HI são ácidos fortes
HF, é um ácido semi-forte
H2S, HCN, é um ácido fraco.
A força dos ácidos é medida pelo grau de ionização. Os ácidos são divididos entre forte e fraco, por exemplo: HCl é um ácido forte e é um eletrólito forte e H3C – COOH é ácido fraco e é um eletrólito fraco.
Observe a tabela:

É possível classificar os oxoácidos em fortes, fraco ou semifortes, através da seguinte regra:

O H2CO3 é uma exceção, ele é uma ácido fraco pois como sabemos (3 – 2 = 1) a decomposição resulta em H2O e CO2, o que prova que ele realmente é um ácido fraco.
H2CO3 → H2O + CO2
Essa regra não pode ser aplicada aos hidrácidos.
É importante lembrar que:
HCl, HBr, HI são ácidos fortes
HF, é um ácido semi-forte
H2S, HCN, é um ácido fraco.
ÁCIDO DE ARRHENIUS:
Conceito de ácido segundo a teoria de Arrhenius
Os ácidos são as substâncias no qual libera cátion apenas íons H+ ou H3O+ isso ocorre em solução aquosa. É importante lembrarmos também que quando colocados na água os átomos sofrem ionização:
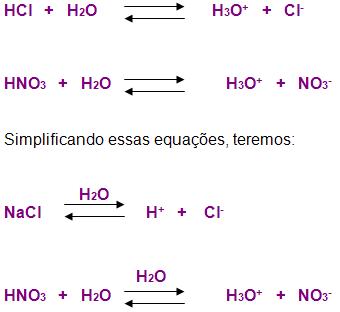
Os ácidos são as substâncias no qual libera cátion apenas íons H+ ou H3O+ isso ocorre em solução aquosa. É importante lembrarmos também que quando colocados na água os átomos sofrem ionização:

BASE DE ARRHENIUS:
Conceito de base segundo a teoria de Arrhenius
Segundo a teoria de Arrhenius, base é uma substância, que em solução, tem a capacidade de libertar como ânion, os íons OH-, ou seja, os hidróxidos.
Vejamos um exemplo:
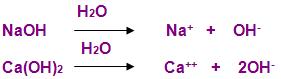
Segundo a teoria de Arrhenius, base é uma substância, que em solução, tem a capacidade de libertar como ânion, os íons OH-, ou seja, os hidróxidos.
Vejamos um exemplo:

SAL DE ARRHENIUS:
Conceito de sal segundo a teoria de Arrhenius
O sal é um composto constituido por cátions originado de uma base e ânion originado de um ácido. Portanto podemos concluir que os sais são considerados compostos iônicos.
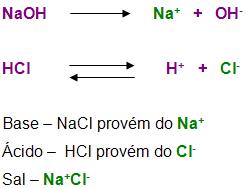
A reação entre um sal e um ácido com formação de água, forma o sal.
ÁCIDO + BASE → SAL + ÁGUA
HCl + NaOH → NaOH + H2O
O sal é um composto constituido por cátions originado de uma base e ânion originado de um ácido. Portanto podemos concluir que os sais são considerados compostos iônicos.

A reação entre um sal e um ácido com formação de água, forma o sal.
ÁCIDO + BASE → SAL + ÁGUA
HCl + NaOH → NaOH + H2O




Nenhum comentário:
Postar um comentário