1. Reações de deslocamento As reações que ocorrem com transferência de elétrons são chamadas de reações de deslocamento. Ao colocar um metal na presença de um cátion pode ocorrer ou não a passagem de elétrons.
2. Reações de deslocamento ou simples troca
Existem dois tipos:
1º tipo:
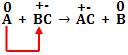
Metal desloca cátion da substância composta.
O metal A é mais reativo, menos nobre que o metal B
Condições: o metal deslocante deve ser mais reativo que o metal deslocado.
Zn + CUSO4 → ZnSO4 + Cu
Cu + ZnSO4 → não existe reação natural
2º tipo:
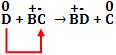
Ametal desloca ânion da substância composta.
O não-metal D é mais reativo que o não-metal C.
Condição: ametal deslocante deve ser mais reativo que ametal deslocado.
F2 + 2NaCl → 2NaF + Cl2
Cl2 + NaF → não existe reação espontânea
Existem dois tipos:
1º tipo:
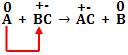
Metal desloca cátion da substância composta.
O metal A é mais reativo, menos nobre que o metal B
Condições: o metal deslocante deve ser mais reativo que o metal deslocado.
Zn + CUSO4 → ZnSO4 + Cu
Cu + ZnSO4 → não existe reação natural
2º tipo:
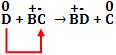
Ametal desloca ânion da substância composta.
O não-metal D é mais reativo que o não-metal C.
Condição: ametal deslocante deve ser mais reativo que ametal deslocado.
F2 + 2NaCl → 2NaF + Cl2
Cl2 + NaF → não existe reação espontânea
3. As reações de deslocamento são reações de oxidorredução
Veja o exemplo abaixo:
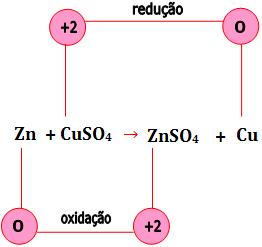
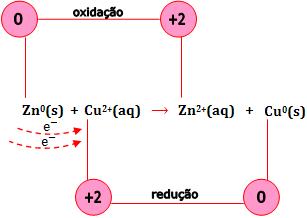
Os elétrons do Zn são transferidos para o Cu+2, conseqüentemente o número de de oxidação varia.
Equação iônica
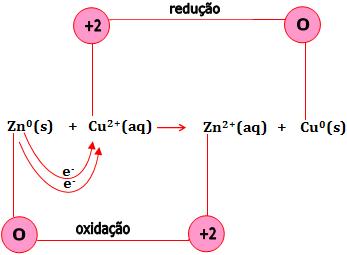
Seja a reação do zinco com sulfato de cobre em solução aquosa:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Os sais encontram-se dissociados em solução aquosa:
Veja que os íons sulfato não participam da reação. Ocorre uma transferência de elétrons do metal zinco para o íon Cu2+.
4. Fila de reatividade química dos metais
Numa reação química, o metal transfere elétrons. Quanto maior for a eletropositividade, mais a reação será facilitada, pois os materiais eletropositivos são mais reativos.
5. Fila de reatividade química dos ametais Quanto maior for a eletronegatividade, maior será a reatividade do não-metal.

Os ametais também sofrem reações espontâneas e reações não-espontâneas.
Exemplo:
Flúor (F2) desloca o iodo dos iodetos (I-).
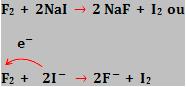
Assim como o iodo (I2) não desloca o cloro dos cloretos (Cl-).

6. Reações com ácidos Os metais mais reativos deslocam hidrogênio dos ácidos.
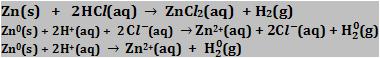
Os metais menos reativos não deslocam hidrogênio dos ácidos.
8. Conclusões: O que significa deslocar?
Quando dizemos que um metal A deslocou um metal B, significa que A cedeu elétrons para o cátion de B.
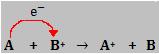
Quando, por exemplo, um metal C não deslocar um metal D, dizemos que C não pode ceder elétrons para o cátion D.

9. Eletroquímica
Eletroquímica é o estudo das reações nas quais ocorre conversão de energia química em energia elétrica e vice-versa.
Numa pilha galvânica ocorre a conversão de energia química em energia elétrica, já numa eletrólise ocorre a conversão de energia elétrica em energia química.

Em eletroquímica estudamos as reações de oxidorredução que geram ou consomem energia.
Eletroquímica é o estudo das reações nas quais ocorre conversão de energia química em energia elétrica e vice-versa.
Numa pilha galvânica ocorre a conversão de energia química em energia elétrica, já numa eletrólise ocorre a conversão de energia elétrica em energia química.

Em eletroquímica estudamos as reações de oxidorredução que geram ou consomem energia.
10. Semi-reação de oxidação e redução
Seja uma reação que ocorre quando submergimos uma barra de zinco numa solução contida de íons Cu+2, obtida através da dissolução de sulfato de cobre em água.
Normalmente, a reação que ocorrerá pode ser representada pela equação abaixo:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Os sais estão dissociados:
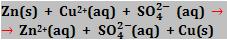
Veja que os íons não participam de fato da reação:
A reação é formada a partir de uma conversão de elétrons do átomo de zinco para o íon Cu2+.
Na reação citada, cobre metálico é depositado na superfície do zinco e a cor azul do íon Cu2+ oculta-se quando é substituído pelo íons Zn+2 incolor.
A reação pode ser dividida em duas partes:

Ao somar as duas semi-reações, obtemos a reação global. Veja que o número de elétrons cedidos é igual ao número de elétrons recebidos.
Seja uma reação que ocorre quando submergimos uma barra de zinco numa solução contida de íons Cu+2, obtida através da dissolução de sulfato de cobre em água.
Normalmente, a reação que ocorrerá pode ser representada pela equação abaixo:
Zn(s) + CuSO4(aq) → ZnSO4(aq) + Cu(s)
Os sais estão dissociados:
Veja que os íons não participam de fato da reação:

A reação é formada a partir de uma conversão de elétrons do átomo de zinco para o íon Cu2+.
Na reação citada, cobre metálico é depositado na superfície do zinco e a cor azul do íon Cu2+ oculta-se quando é substituído pelo íons Zn+2 incolor.
A reação pode ser dividida em duas partes:

Ao somar as duas semi-reações, obtemos a reação global. Veja que o número de elétrons cedidos é igual ao número de elétrons recebidos.
11. Pilha de Daniell
Podemos chamar de pilha eletroquímica, célula galvânica, célula eletroquímica ou célula voltaica o dispositivo no qual ocorre uma reação de oxidorredução que produz corrente elétrica.
Uma pilha eletroquímica realiza a conversão de energia química em energia elétrica. Na pilha acontece uma reação de oxidorredução espontânea.
A pilha de Daniell é baseada na reação:
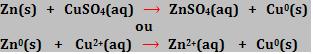
Ao mergulhar uma barra de zinco numa solução aquosa de CuSO4, os íons Cu2+ reagem diretamente com a barra de zinco, sendo assim, é impossível obter uma corrente elétrica útil.
Para que uma reação seja utilizada como fonte de energia elétrica deve ocorrer uma transferência indireta de elétrons. Os elétrons liberados pelos átomos de zinco devem atravessar um circuito externo antes de converter os íons Cu2+ em átomos de cobre. Como o oxidante e o redutor estão separados em compartimentos diferentes, o redutor entrega os elétrons ao oxidante por meio de um circuito externo.
Podemos chamar de pilha eletroquímica, célula galvânica, célula eletroquímica ou célula voltaica o dispositivo no qual ocorre uma reação de oxidorredução que produz corrente elétrica.
Uma pilha eletroquímica realiza a conversão de energia química em energia elétrica. Na pilha acontece uma reação de oxidorredução espontânea.
A pilha de Daniell é baseada na reação:
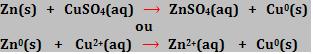
Ao mergulhar uma barra de zinco numa solução aquosa de CuSO4, os íons Cu2+ reagem diretamente com a barra de zinco, sendo assim, é impossível obter uma corrente elétrica útil.
Para que uma reação seja utilizada como fonte de energia elétrica deve ocorrer uma transferência indireta de elétrons. Os elétrons liberados pelos átomos de zinco devem atravessar um circuito externo antes de converter os íons Cu2+ em átomos de cobre. Como o oxidante e o redutor estão separados em compartimentos diferentes, o redutor entrega os elétrons ao oxidante por meio de um circuito externo.
12. Montagem da pilha de Daniell
Considere uma barra de zinco submergida numa solução de sulfato de zinco (ZnSO4), e uma barra de cobre submergida numa solução de sulfato de cobre (CuSO4).
Tais soluções estão separadas por uma parede porosa, que permite a passagem dos íons de uma solução para outra, porém, impedindo o contato direto entre átomos de Zn e íons Cu2+.
O conjunto eletrodo + solução é denominado semipilha ou meia pilha. Portanto, a pilha é a fusão de duas semipilhas.
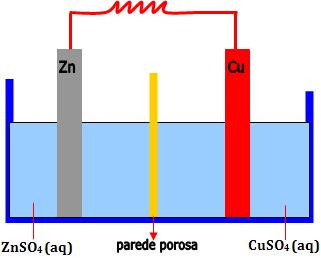
13. Funcionamento da pilha
Semipilha de Zinco
Sabemos que o zinco é mais reativo que o cobre, portanto, o zinco perde elétrons com mais facilidade.
O eletrodo de zinco sofre oxidação
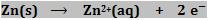
O eletrodo no qual ocorre a oxidação é definido como ânodo, sendo o pólo negativo da pilha, pois bombeia os elétrons para o circuito externo.
A barra de zinco diminui de massa, isto significa que, ela sofreu uma corrosão.
Semipilha do cobre
O íon do metal menos reativo é reduzido, isto significa que, recebe elétron proveniente do ânodo por meio do circuito externo.

O eletrodo no qual ocorre a redução é definido como cátodo, sendo o pólo positivo da pilha, pois absorve elétrons do circuito externo.
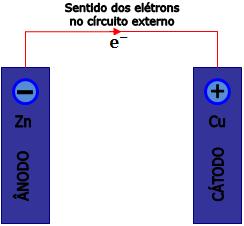
A barra de cobre aumenta de massa, isto significa que, ocorre deposição de átomos de cobre.
Equação global da pilha
Consiste na soma das equações das semi-reações que ocorrem no ânodo e no cátodo.
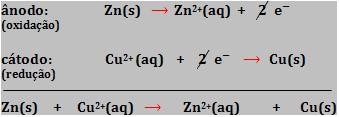
A placa porosa
A solução que banha que inunda a placa de zinco apresenta um acréscimo na concentração de íons Zn++. A solução que inunda a placa de cobre apresenta um decréscimo na concentração de íons Cu++.
Nesse caso, podemos imaginar que a solução que inunda a placa de zinco possa ficar positiva, e que a solução que inunda a placa de cobre possa ficar negativa, mas isto não é possível, graças à placa porosa.
Os íons que neutralizam a solução atravessam a placa porosa. Desse modo, íons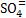 partem do compartimento onde fica a placa de cobre e chegam até o compartimento onde fica a placa de zinco, impedindo o acréscimo de íons positivos.
partem do compartimento onde fica a placa de cobre e chegam até o compartimento onde fica a placa de zinco, impedindo o acréscimo de íons positivos.
Da mesma forma, os íons positivos (Zn++) partem do compartimento onde fica a placa de zinco e chegam até o compartimento onde fica a placa de cobre, neutralizando a falta de íons positivos.
A ponte salina
A cuba com dois compartimentos separados por uma parede porosa pode ser substituída por um dispositivo formado por dois béqueres diferentes, na qual a conexão entre as suas soluções se faz por um tubo de vidro em forma de U contido de uma solução salina, tal tubo é denominado ponte salina.
A solução salina é formada geralmente por KCl, KNO3, NH4, NO3, tal solução não deve participar efetivamente das reações nos eletrodos nem reagir com as soluções. As extremidades do tubo são fechadas com um material poroso, como por exemplo, o chumaço de algodão.
A ponte salina permite a troca de íons, sem que as soluções se misturem, completando o circuito elétrico.
Diagrama da pilha
A pilha normalmente é representada da seguinte forma:
Zn / Zn2+ || Cu2+ / Cu
À esquerda temos a oxidação, ou seja, a reação no ânodo (átomos de Zn são oxidados a íons Zn2+).
O símbolo || representa a ponte salina ou a parede porosa.
À direita temos a redução, ou seja, a reação no cátodo (íons Cu2+ são reduzidos a átomos Cu).
Diagrama da Pilha
ÂNODO || CÁTODO
Semipilha de Zinco
Sabemos que o zinco é mais reativo que o cobre, portanto, o zinco perde elétrons com mais facilidade.
O eletrodo de zinco sofre oxidação
O eletrodo no qual ocorre a oxidação é definido como ânodo, sendo o pólo negativo da pilha, pois bombeia os elétrons para o circuito externo.
A barra de zinco diminui de massa, isto significa que, ela sofreu uma corrosão.
Semipilha do cobre
O íon do metal menos reativo é reduzido, isto significa que, recebe elétron proveniente do ânodo por meio do circuito externo.
O eletrodo no qual ocorre a redução é definido como cátodo, sendo o pólo positivo da pilha, pois absorve elétrons do circuito externo.

A barra de cobre aumenta de massa, isto significa que, ocorre deposição de átomos de cobre.
Equação global da pilha
Consiste na soma das equações das semi-reações que ocorrem no ânodo e no cátodo.
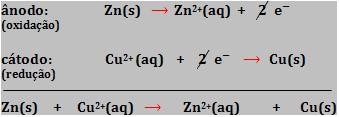
A placa porosa
A solução que banha que inunda a placa de zinco apresenta um acréscimo na concentração de íons Zn++. A solução que inunda a placa de cobre apresenta um decréscimo na concentração de íons Cu++.
Nesse caso, podemos imaginar que a solução que inunda a placa de zinco possa ficar positiva, e que a solução que inunda a placa de cobre possa ficar negativa, mas isto não é possível, graças à placa porosa.
Os íons que neutralizam a solução atravessam a placa porosa. Desse modo, íons
Da mesma forma, os íons positivos (Zn++) partem do compartimento onde fica a placa de zinco e chegam até o compartimento onde fica a placa de cobre, neutralizando a falta de íons positivos.
A ponte salina
A cuba com dois compartimentos separados por uma parede porosa pode ser substituída por um dispositivo formado por dois béqueres diferentes, na qual a conexão entre as suas soluções se faz por um tubo de vidro em forma de U contido de uma solução salina, tal tubo é denominado ponte salina.
A solução salina é formada geralmente por KCl, KNO3, NH4, NO3, tal solução não deve participar efetivamente das reações nos eletrodos nem reagir com as soluções. As extremidades do tubo são fechadas com um material poroso, como por exemplo, o chumaço de algodão.
A ponte salina permite a troca de íons, sem que as soluções se misturem, completando o circuito elétrico.
Diagrama da pilha
A pilha normalmente é representada da seguinte forma:
Zn / Zn2+ || Cu2+ / Cu
À esquerda temos a oxidação, ou seja, a reação no ânodo (átomos de Zn são oxidados a íons Zn2+).
O símbolo || representa a ponte salina ou a parede porosa.
À direita temos a redução, ou seja, a reação no cátodo (íons Cu2+ são reduzidos a átomos Cu).
Diagrama da Pilha
ÂNODO || CÁTODO
14. Voltagem de uma pilha
Sabemos que a pilha Daniell está baseada na seguinte reação:
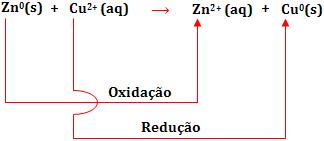
Na pilha eletroquímica a oxidação e a redução são realizadas em compartimentos diferentes.
O eletrodo de zinco submergido numa solução de ZnSO4 é denominado semipilha de oxidação, já o eletrodo de cobre mais a solução de CuSO4 é denominado semipilha de redução.
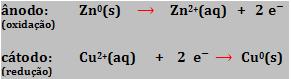
Equação global consiste na soma das duas semi-reações.
No circuito externo, os elétrons partem do ânodo para o cátodo. Se uma corrente fluir entre dois pontos, dizemos que ocorre uma diferença de potencial (ddp) entre esses dois pontos. Portanto, existe uma ddp entre os dois eletrodos, denominada voltagem da pilha, potencial da célula ou força eletromotriz da pilha.
A voltagem das pilhas depende da concentração dos íons, temperatura e pressão dos gases envolvidos na reação.
Sabemos que a pilha Daniell está baseada na seguinte reação:

Na pilha eletroquímica a oxidação e a redução são realizadas em compartimentos diferentes.
O eletrodo de zinco submergido numa solução de ZnSO4 é denominado semipilha de oxidação, já o eletrodo de cobre mais a solução de CuSO4 é denominado semipilha de redução.
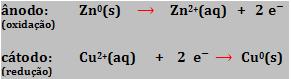
Equação global consiste na soma das duas semi-reações.
No circuito externo, os elétrons partem do ânodo para o cátodo. Se uma corrente fluir entre dois pontos, dizemos que ocorre uma diferença de potencial (ddp) entre esses dois pontos. Portanto, existe uma ddp entre os dois eletrodos, denominada voltagem da pilha, potencial da célula ou força eletromotriz da pilha.
A voltagem das pilhas depende da concentração dos íons, temperatura e pressão dos gases envolvidos na reação.
15. Voltagem-padrão
Voltagem da célula padrão ocorre quando todas as concentrações são 1 mol/L, todas as pressões parciais dos gases são 1 atm e a temperatura é 25°C.
Podemos representá-las por:
Para a pilha de Daniell temos:
16. Potencial de eletrodo
Podemos considerar que o potencial total da pilha é a soma dos potenciais das duas semipilhas: Eox, devido à semi-reação de oxidação e Ered, devido à semi-reação de redução.
Epilha = Eox + Ered
Para as condições padrão (25ºC, 1atm, 1mol/L) temos:
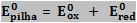
Para a pilha de Daniell:
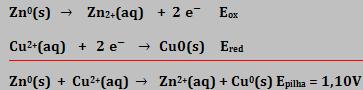
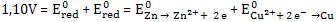
Não é possível determinar por experiência a voltagem individual de uma meia-reação. Portanto, temos uma grandeza conhecida que é Epilha = 1,10V, e duas incógnitas que são Eox e Ered.
Para resolver a questão, usamos a seguinte convenção: consideramos a voltagem-padrão para a redução de íons H+ a H2, como sendo zero.
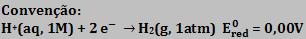
Podemos considerar que o potencial total da pilha é a soma dos potenciais das duas semipilhas: Eox, devido à semi-reação de oxidação e Ered, devido à semi-reação de redução.
Epilha = Eox + Ered
Para as condições padrão (25ºC, 1atm, 1mol/L) temos:
Para a pilha de Daniell:
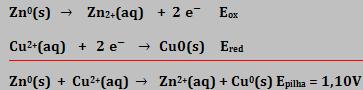
Não é possível determinar por experiência a voltagem individual de uma meia-reação. Portanto, temos uma grandeza conhecida que é Epilha = 1,10V, e duas incógnitas que são Eox e Ered.
Para resolver a questão, usamos a seguinte convenção: consideramos a voltagem-padrão para a redução de íons H+ a H2, como sendo zero.
17. Eletrodo-padrão de hidrogênio
Como sabemos o hidrogênio é um gás, e por isso utilizamos um eletrodo inerte, ou seja, um material não reativo que conduz corrente elétrica; normalmente esse eletrodo é a platina. O gás H2 é borbulhado em torno do eletrodo da platina que está mergulhado numa solução que contém íons H+. O hidrogênio fica detido na superfície da platina. Utilizando uma solução nas condições padrão (1 mol/L de H+, pressão do H2 a 1 atm e a 25°C), temos o eletrodo-padrão de hidrogênio.
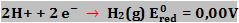
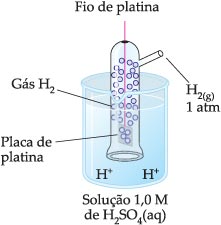
Como sabemos o hidrogênio é um gás, e por isso utilizamos um eletrodo inerte, ou seja, um material não reativo que conduz corrente elétrica; normalmente esse eletrodo é a platina. O gás H2 é borbulhado em torno do eletrodo da platina que está mergulhado numa solução que contém íons H+. O hidrogênio fica detido na superfície da platina. Utilizando uma solução nas condições padrão (1 mol/L de H+, pressão do H2 a 1 atm e a 25°C), temos o eletrodo-padrão de hidrogênio.

18. Medida do potencial-padrão do zinco
Podemos usar a pilha esquematizada abaixo para mensurar o potencial-padrão de redução do zinco.
O zinco é mais reativo que o hidrogênio, portanto sofre oxidação.
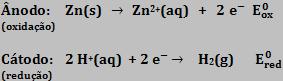
Equação global
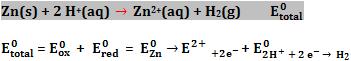
Através de um voltímetro, determina-se experimentalmente:
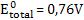
Logo, temos:
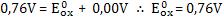
Podemos determinar o potencial de redução do zinco invertendo a semi-reação de oxidação:
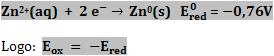
Podemos usar a pilha esquematizada abaixo para mensurar o potencial-padrão de redução do zinco.

O zinco é mais reativo que o hidrogênio, portanto sofre oxidação.
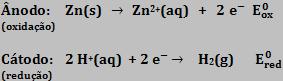
Equação global
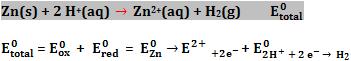
Através de um voltímetro, determina-se experimentalmente:
Logo, temos:
Podemos determinar o potencial de redução do zinco invertendo a semi-reação de oxidação:
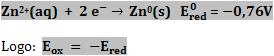
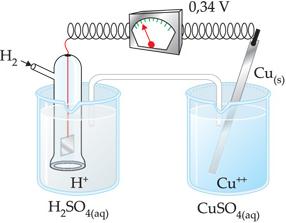
19. Medida do potencial-padrão do cobre
Através da pilha esquematizada a seguir, podemos mensurar o potencial de redução do cobre.
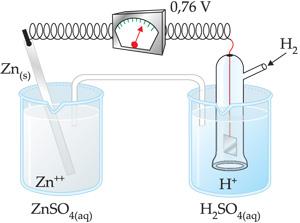
O cobre é menos reativo que o hidrogênio, portanto, o H2 sofre oxidação.
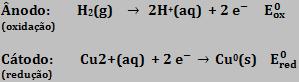
Equação global
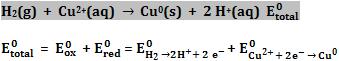
Podemos determinar experimentalmente que Etotal = 0,34V.
Logo, temos:
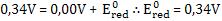
Podemos determinar o potencial-padrão de oxidação do cobre invertendo a semi-reação de redução:
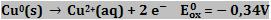
Através da pilha esquematizada a seguir, podemos mensurar o potencial de redução do cobre.

O cobre é menos reativo que o hidrogênio, portanto, o H2 sofre oxidação.
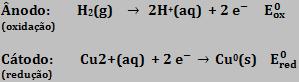
Equação global
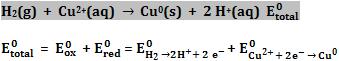
Podemos determinar experimentalmente que Etotal = 0,34V.
Logo, temos:
Podemos determinar o potencial-padrão de oxidação do cobre invertendo a semi-reação de redução:
20. Significado dos potenciais
O potencial de redução (Ered) é uma grandeza que mede a capacidade que o eletrodo apresenta de sofrer redução.
Quanto maior for o potencial de redução, mais fácil será para acontecer a redução.
Exemplo:
Considere os potenciais de redução:
Conclusão: o íon Cu2+ sofre redução com mais facilidade que o íon Zn2+.
O potencial de oxidação (Eox) é uma grande que mede a capacidade que o eletrodo apresenta de sofrer oxidação.
Quanto maior for o potencial de oxidação, mais fácil será para acontecer a oxidação.
Exemplo:
Considere os potenciais de oxidação:
Conclusão: o Zn0 sofre oxidação com mais facilidade que o Cu0.
21. Calculo da voltagem de uma reação de oxidorredução
Toda reação que ocorre numa pilha é espontânea e a sua voltagem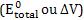 pode ser determinada pela expressão abaixo:
pode ser determinada pela expressão abaixo:
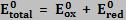
A voltagem de uma reação de oxidorredução qualquer pode ser determinada de diversas formas.
Sabendo que o ânodo fornece elétrons para o circuito externo e já o cátodo recebe elétrons do circuito externo e que Eox = -Ered, a voltagem pode ser calculada pelas seguintes expressões:
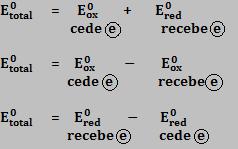
Toda reação que ocorre numa pilha é espontânea e a sua voltagem
A voltagem de uma reação de oxidorredução qualquer pode ser determinada de diversas formas.
Sabendo que o ânodo fornece elétrons para o circuito externo e já o cátodo recebe elétrons do circuito externo e que Eox = -Ered, a voltagem pode ser calculada pelas seguintes expressões:
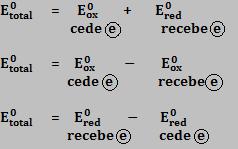
22. Espontaneidade de uma reação de oxidorredução
Sabemos que a reação que ocorre numa pilha é espontânea e a voltagem é sempre positiva, portanto, podemos afirmar que:
• Quando a voltagem calculada para a reação (Etotal ou ∆V) for de valor positivo, a reação será espontânea.
Etotal > 0 ⇒ reação espontânea.
Exemplo:
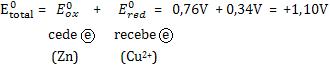
A reação é espontânea.
• Quando a voltagem calculada para a reação for de valor negativo, a reação não será espontânea. Então, a reação inversa será espontânea.
Etotal < 0 ⇒ reação não-espontânea
Exemplo:
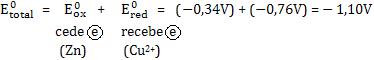
A reação direta é não-espontânea, a reação inversa será espontânea.
23. Força de um oxidante
Todo oxidante sofre redução, ou seja, ganha elétrons.
Um bom oxidante ganha elétrons com facilidade, pois tem grande capacidade de sofrer redução, ou seja, tem grande potencial de redução.
Como oxidante o cátion Cu++ é melhor do que o cátion Zn++, pois o potencial de redução do cobre é maior que o do zinco.

24. Força de um redutor
Todo redutor sofre oxidação, ou seja, perde elétrons.
Um bom redutor perde elétrons com facilidade, pois tem grande capacidade de oxidação, ou seja, apresenta grande potencial de oxidação. Como redutor o Zn é melhor que o Cu, pois o potencial de oxidação do zinco é maior que o do cobre.
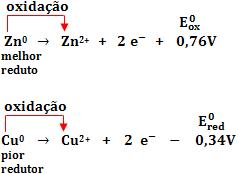
Todo redutor sofre oxidação, ou seja, perde elétrons.
Um bom redutor perde elétrons com facilidade, pois tem grande capacidade de oxidação, ou seja, apresenta grande potencial de oxidação. Como redutor o Zn é melhor que o Cu, pois o potencial de oxidação do zinco é maior que o do cobre.
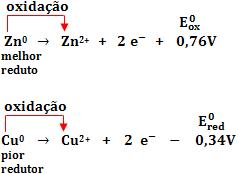
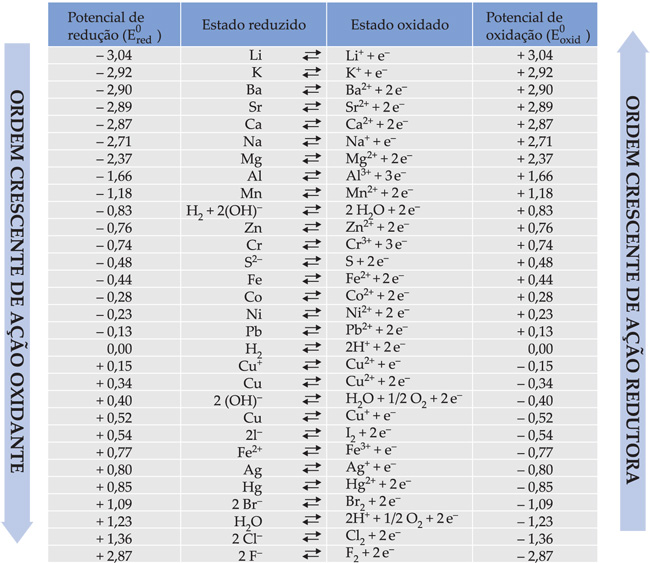
25. Tabela de potenciais-padrão de redução

26. Corrosão
O processo de corrosão dos metais abrange a oxidação e a redução.
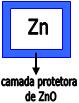
Nos metais como o Zn, Al, Cr, forma-se uma camada delgada de óxido que adere à superfície do metal. Tal camada evita que a oxidação prossiga.
Para o ferro, a ferrugem (óxido de ferro) não apresenta aderência com a superfície do metal e a oxidação continua. Para que ocorra o enferrujamento é necessária a presença do oxigênio e da água; um ferro não enferruja somente na presença da água ou somente na presença do oxigênio.
Colocando uma barra de ferro em contato com a água que contém O2 dissolvido, o ferro é oxidado (região anódica):
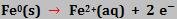
As moléculas de oxigênio são reduzidas (região catódica):

Ao somar as duas semi-reações e considerando que Fe(OH)2 é insolúvel, temos:
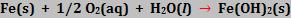
Os íons dissolvidos na água sofrem oxidação:
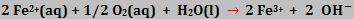
Os íons Fe3+ e OH- se unem, constituindo o óxido de ferro hidratado na cor castanho-avermelhada:
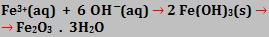
Concluindo, a corrosão do ferro apresenta um mecanismo eletroquímico.
O processo de corrosão dos metais abrange a oxidação e a redução.
Nos metais como o Zn, Al, Cr, forma-se uma camada delgada de óxido que adere à superfície do metal. Tal camada evita que a oxidação prossiga.

Para o ferro, a ferrugem (óxido de ferro) não apresenta aderência com a superfície do metal e a oxidação continua. Para que ocorra o enferrujamento é necessária a presença do oxigênio e da água; um ferro não enferruja somente na presença da água ou somente na presença do oxigênio.
Colocando uma barra de ferro em contato com a água que contém O2 dissolvido, o ferro é oxidado (região anódica):
As moléculas de oxigênio são reduzidas (região catódica):
Ao somar as duas semi-reações e considerando que Fe(OH)2 é insolúvel, temos:
Os íons dissolvidos na água sofrem oxidação:
Os íons Fe3+ e OH- se unem, constituindo o óxido de ferro hidratado na cor castanho-avermelhada:
Concluindo, a corrosão do ferro apresenta um mecanismo eletroquímico.
27. Proteção do ferro
Todo objeto de aço pode ser protegido para evitar a corrosão:
a) Cobertura com uma camada protetora
Ao cobrir o ferro com uma camada de tinta, esmalte, óleo ou graxa evita-se o contato do mesmo com a água e o oxigênio, evitando a corrosão.
b) Cobertura com uma camada de metal menos reativo que o ferro
Nas latas estanhadas usa-se uma camada de estanho sobre o ferro da lata. O óxido de estanho adere-se à superfície, protegendo o ferro da corrosão. Porém, se houver um amassamento ou rachadura na camada protetora o enferrujamento pode ser acelerado, pois ocorre a reação:

Para que isso não ocorra é necessário cobrir o estanho com uma camada de plástico.
O potencial de redução do estanho é mais alto do que o do ferro, assim o estanho atuará como semi-reação de redução e o ferro como oxidação.
c) Cobertura com uma camada de metal mais reativo que o ferro
Para esse tipo de proteção o zinco é o mais utilizado, cujos óxidos aderem-se à superfície. Caso a superfície seja danificada, o ferro sofre redução e o zinco sofre oxidação. O zinco se oxida mais facilmente que o ferro.
O aço que possui uma proteção de camada de zinco é chamado de aço galvanizado.
d) Contato elétrico com um metal mais reativo
É um tipo de proteção catódica.
Coloca-se o ferro em contato com um metal mais reativo, ou seja, com um potencial de redução menor que o do ferro, como por exemplo, o magnésio. Tal metal é conhecido como “metal de sacrifício”, atuando como ânodo enquanto o ferro atua como cátodo. A proteção só termina quando o metal sacrifício for completamente dissolvido.
Esse tipo de proteção é bastante utilizada em cascos de embarcações.
Todo objeto de aço pode ser protegido para evitar a corrosão:
a) Cobertura com uma camada protetora
Ao cobrir o ferro com uma camada de tinta, esmalte, óleo ou graxa evita-se o contato do mesmo com a água e o oxigênio, evitando a corrosão.
b) Cobertura com uma camada de metal menos reativo que o ferro
Nas latas estanhadas usa-se uma camada de estanho sobre o ferro da lata. O óxido de estanho adere-se à superfície, protegendo o ferro da corrosão. Porém, se houver um amassamento ou rachadura na camada protetora o enferrujamento pode ser acelerado, pois ocorre a reação:
Para que isso não ocorra é necessário cobrir o estanho com uma camada de plástico.
O potencial de redução do estanho é mais alto do que o do ferro, assim o estanho atuará como semi-reação de redução e o ferro como oxidação.
c) Cobertura com uma camada de metal mais reativo que o ferro
Para esse tipo de proteção o zinco é o mais utilizado, cujos óxidos aderem-se à superfície. Caso a superfície seja danificada, o ferro sofre redução e o zinco sofre oxidação. O zinco se oxida mais facilmente que o ferro.
O aço que possui uma proteção de camada de zinco é chamado de aço galvanizado.
d) Contato elétrico com um metal mais reativo
É um tipo de proteção catódica.
Coloca-se o ferro em contato com um metal mais reativo, ou seja, com um potencial de redução menor que o do ferro, como por exemplo, o magnésio. Tal metal é conhecido como “metal de sacrifício”, atuando como ânodo enquanto o ferro atua como cátodo. A proteção só termina quando o metal sacrifício for completamente dissolvido.
Esse tipo de proteção é bastante utilizada em cascos de embarcações.
28. Pilhas comerciais
Pilha seca (pilha de Leclanché)
O recipiente é constituído de zinco, atuando como ânodo.
Há um papelão poroso que separa o zinco dos demais materiais. O eletrodo central é de grafita, e atua como cátodo. Existe uma pasta úmida que fica entre os eletrodos que apresenta ZnCl2 e NH4Cl. O cátodo é envolvido por uma camada de MnO2.
A voltagem fornecida por essa pilha é 1,5V.
Ânodo
Cátodo
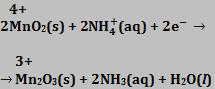
Pilha alcalina
É uma pilha seca de Zn e MnO2, a solução eletrolítica é base forte (KOH).
Sua voltagem também é de 1,5V, porém sua duração é cinco vezes maior que a pilha seca de Leclanché.
Ânodo

Cátodo
Pilha de mercúrio
É um tipo de pilha alcalina que está contida num recipiente feito de aço. Formada por um ânodo de zinco e um cátodo de óxido de mercúrio II (HgO). A solução eletrolítica é uma pasta de KOH e Zn(OH)2.
Ânodo
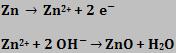
Cátodo
Equação Global
Pilha de lítio
O ânodo é feito de metal lítio e o cátodo é de MnO2 ou cloreto de sulfurila (SOCl2)
As pilhas de lítio são apresentam uma alta voltagem: 3,4V.
Ânodo
Cátodo

Pilha de combustível
Nas pilhas de combustível o oxigênio (oxidante) e o hidrogênio (redutor) reagem formando água e liberando energia em forma de energia elétrica.
Este tipo de pilha tem um rendimento bastante elevado, e atualmente é usada em projetos espaciais.
Ânodo
Cátodo
Equação Global
Pilhas recarregáveis
As pilhas não-recarregáveis, que são aquelas que são utilizadas uma vez e depois são descartadas, estas são chamadas de pilhas primárias. Nessas pilhas os materiais de oxidação e de redução não permanecem no ânodo e no cátodo, por isso é impossível reverter a situação.
As pilhas recarregáveis são aquelas que depois de utilizadas pode ser recarregadas e utilizadas novamente, estas são chamadas de pilhas secundárias. Nessas pilhas os materiais de oxidação ficam no ânodo e os materiais de redução permanecem no cátodo, sendo possível inverter as reações.
ELETRÓLISE:
1. Eletrólise: um processo não-espontâneo
A eletrólise é um processo que realiza a decomposição de uma substância através da energia elétrica. Portanto, é uma reação não espontânea, pois é provocada pela energia elétrica derivada de um gerador. Sem dúvida, consiste numa reação de oxidorredução: íons positivos ganham elétrons (redução) e íons negativos perdem elétrons (oxidação).
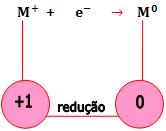
- cátions descarregam-se no cátodo, sofrendo redução.
- Ânions descarregam-se no ânodo, sofrendo oxidação.
2. A célula eletrolítica A eletrólise é um processo que realiza a decomposição de uma substância através da energia elétrica. Portanto, é uma reação não espontânea, pois é provocada pela energia elétrica derivada de um gerador. Sem dúvida, consiste numa reação de oxidorredução: íons positivos ganham elétrons (redução) e íons negativos perdem elétrons (oxidação).
- cátions descarregam-se no cátodo, sofrendo redução.
- Ânions descarregam-se no ânodo, sofrendo oxidação.
A célula é um dispositivo formado por dois eletrodos: A (ânodo) e C (cátions), submergidos num líquido contido de íons livres, como o M+ e X-.
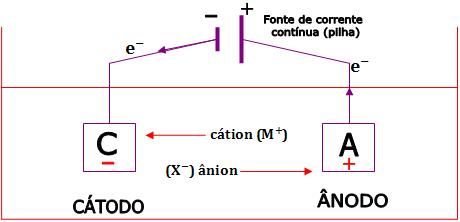
Seja o composto genérico MX. Numa solução aquosa, ele dissocia:
MX → M+ + X-
Veja o que ocorre utilizando a energia elétrica:
Redução no cátodo
Redução do ânodo
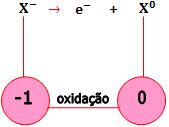
Os ânions cedem elétrons para o ânodo. Os elétrons percorrem o circuito. Os cátions recebem elétrons do cátodo.
Liga-se uma bateria aos eletrodos A e C através de dois fios. A bateria bombeia elétrons, empurrando-os para o eletrodo C e retirando-os do eletrodo A.
Ao fornecer energia elétrica para uma célula eletrolítica, ocorre a eletrólise. Conclusão: a célula eletrolítica transforma a energia elétrica em energia química.
A liberdade de movimento dos íons pode ser adquirida através da:
- fusão: eletrólise ígnea
- dissolução em um solvente polar: eletrólise em solução.
4. Obtenção do alumínio A obtenção do alumínio se dá a partir do minério de bauxita (Al2O3 . 2 H2O) por redução eletrolítica.
A bauxita é purificada e dissolvida em criolita fundida (Na3AlF6) e eletrolisada numa temperatura de 1000°C.
O ânodo é formado por barras de grafita submergidas na mistura fundida. O cátodo é uma caixa de ferro coberta de grafita.
O alumínio líquido forma-se no cátodo.
A criolita reduz o ponto de fusão, logo que o Al2O3 funde a 2050°C.
O ânodo de grafita se junta com o gás oxigênio e forma o dióxido de carbono (CO2). Assim, posteriormente, novos ânodos serão dispostos na célula.
6. Descarga de cátions
Os íons que apresentam maior potencial de redução serão descarregados primeiro.
Os cátions de metais menos reativos ganham elétrons facilmente, os de mais reativos apresentam mais dificuldade.
7. Descarga de ânions
Um ânion é descarregado quando perde elétrons, e conseqüentemente sofre uma oxidação.
Quanto mais o ânion for eletronegativo, mais difícil será para descarregá-lo. Deste modo, os ânions oxigenados e o F- apresentam grande dificuldade em ceder elétrons.
Para conhecer a ordem de descarga de ânions, temos que saber se estes íons perdem elétrons para o OH- facilmente ou dificilmente.
Descarga de OH-
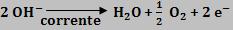

Um ânion é descarregado quando perde elétrons, e conseqüentemente sofre uma oxidação.
Quanto mais o ânion for eletronegativo, mais difícil será para descarregá-lo. Deste modo, os ânions oxigenados e o F- apresentam grande dificuldade em ceder elétrons.
Para conhecer a ordem de descarga de ânions, temos que saber se estes íons perdem elétrons para o OH- facilmente ou dificilmente.
Descarga de OH-

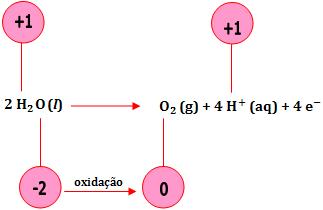
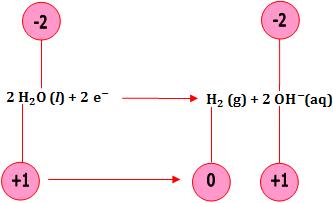
8. Redução e oxidação da água.
A água pode sofrer oxidação e redução.
- Oxidação da água (ânodo)
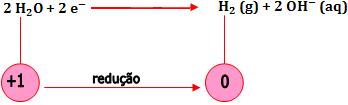
- Oxidação da água (cátodo)
9. Previsão dos produtos de eletrolise em solução aquosa
É difícil prever quais reações ocorrerão nos eletrodos. A redução do cátion ou da água e a oxidação do ânion ou da água dependem da facilidade de ocorrerem tais reações. A seguir vamos estudar as reações mais comuns.
10. Redução (cátodo)
- Redução de moléculas de água
É muito difícil que os cátions dos metais alcalinos, alcalinoterrosos e Al3+ reduzam-se ao metal. Então, as moléculas de água é que são reduzidas.
- Redução de íons H+
A redução dos íons H+ ocorre numa solução aquosa de ácido forte (HCl, H2SO4)
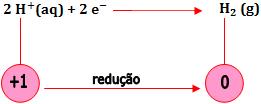
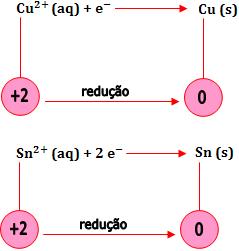
- Redução de um cátion ao metal correspondente
Os cátions dos metais de transição e pós-transição se reduzem com facilidade.
- Redução de moléculas de água
É muito difícil que os cátions dos metais alcalinos, alcalinoterrosos e Al3+ reduzam-se ao metal. Então, as moléculas de água é que são reduzidas.

- Redução de íons H+
A redução dos íons H+ ocorre numa solução aquosa de ácido forte (HCl, H2SO4)

- Redução de um cátion ao metal correspondente
Os cátions dos metais de transição e pós-transição se reduzem com facilidade.

11. Oxidação (ânodo)
- Oxidação de moléculas de água
Dificilmente o ânion fluoreto (F-) e os ânions oxigenados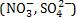 são oxidados. Então, as moléculas de água é que são oxidadas.
são oxidados. Então, as moléculas de água é que são oxidadas.
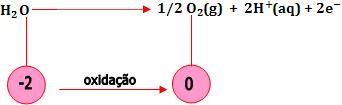
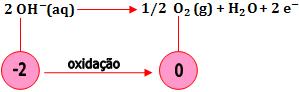
- Oxidação de íons OH-
A oxidação dos íons OH- ocorre numa solução aquosa de base forte (NaOH, Ba(OH)2).
- Oxidação de um ânion ao não-metal correspondente
Os ânions não-oxigenados (I-,Br-,Cl-) são oxidados com facilidade.
12. Eletrólise de solução aquosa de NaCl, com eletrodos inertes (platina).- Oxidação de moléculas de água
Dificilmente o ânion fluoreto (F-) e os ânions oxigenados

- Oxidação de íons OH-
A oxidação dos íons OH- ocorre numa solução aquosa de base forte (NaOH, Ba(OH)2).

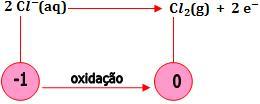
- Oxidação de um ânion ao não-metal correspondente
Os ânions não-oxigenados (I-,Br-,Cl-) são oxidados com facilidade.

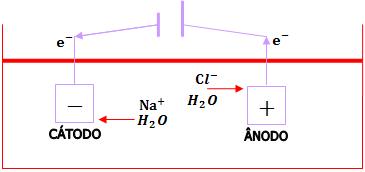
 O Na+ e o OH- permanecem na cuba (processo de obtenção de NaOH).
O Na+ e o OH- permanecem na cuba (processo de obtenção de NaOH).13. Eletrólise de solução aquosa de H2SO4, com eletrodos inertes (platina).
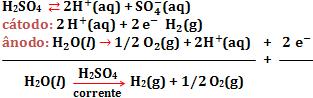
Observamos, de fato, que a água sofreu uma decomposição, enquanto o H2SO4 só serviu para aumentar a condutividade elétrica da solução.
Observamos que para as mesas condições de temperatura e pressão, o volume de H2 obtido é o dobro do volume de O2.
14. Eletrolise de solução aquosa de CuCl2 com eletrodos inertes
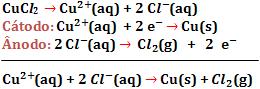
15. Eletrolise do KOH em solução aquosa, com eletrodos de platina
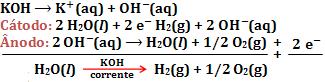 Observamos que a água sofreu decomposição e que o KOH apenas aumentou a condutividade elétrica da solução.
Observamos que a água sofreu decomposição e que o KOH apenas aumentou a condutividade elétrica da solução.16. Eletrolise de solução aquosa de CuSO4, com eletrodos inertes
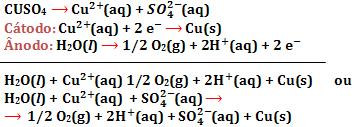
17. Eletrolise de solução aquosa de Na2SO4, com eletrodos inertes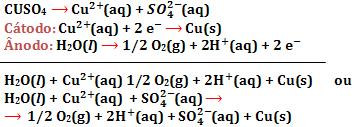
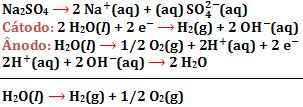 O Na2SO4 serviu para aumentar a condutividade elétrica da solução.
O Na2SO4 serviu para aumentar a condutividade elétrica da solução.18. Eletrolise que utiliza eletrodos não-inertes
Vimos até agora exemplos de eletrólise com eletrodos inertes. Agora veremos a seguir exemplos de eletrólise com eletrodos não-inertes.
- Eletrolise de solução aquosa diluída de HCl, com eletrodos de cobre
Ânodo:
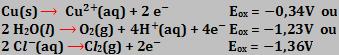
Portanto, o cobre oxida, pois o seu Eox (potencial de oxidação) é maior que o potencial de oxidação da água e do íon cloreto.
O cloreto de cobre II dissolve-se na água.
- Eletrolise de CuSO4 aquoso com eletrodos de cobre
No cátodo, o cobre metálico sofre deposição.
No ânodo, se o metal for mais reativo, o metal oxida. O potencial de oxidação do cobre é maior que o da água.
Portanto, o ânodo é dissolvido.
19. Galvanoplastia
É um processo que consiste em recobrir objetos metálicos com outros metais. É o tipo de tratamento usado na prateação, niquelação, douração, cromagem, etc.
O nome deste processo é uma homenagem ao físico e químico Luigi Galvani, descobridor do galvanismo
20. Obtenção do cobre
A ocorrência do cobre (0, 0001% da crosta) pode ser no estado nativo e combinado: calcopirita (CuFeS2), calcosina (Cu2S), covelita (CuS), cuprita (Cu2O), tenorita (CuO) etc.
Para obter o cobre a partir de sulfetos, fazemos a ustulação do minério concentrado através da flotação.
2 CuFeS2 + 5 O2 → 2 Cu + 2 FeO + 4 SO2
Obtido desse modo o cobre apresenta entre 97% e 99% de pureza. Para purificá-lo devemos utilizar a cela eletrolítica com o ânodo feito de cobre impuro e o cátodo feito de cobre puro.
As impurezas que são oxidadas com mais dificuldade que o cobre, estas são dispostas no fundo da cela, conforme o ânodo vai se dissolvendo, constituindo a lama anódica.
As impurezas que são oxidadas com mais facilidade que o cobre permanecem em solução, pois os íons Cu++ são reduzidos mais rápido, ocorrendo a deposição de cobre puro no cátodo.
Cátodo: Cu2+ + 2 e- → Cu0
Ânodo: Cu0 → 2 e- + Cu2+
21. Eletrolise quantitativa
Quando realizamos a eletrólise da água, o volume que obtemos de H2(g) no cátodo é o dobro do volume que obtemos de O2(g) no ânodo.
Agora vamos aprender a calcular a quantidade de substância liberada num eletrodo.
Sendo:
i – intensidade de corrente.
Q – quantidade de carga elétrica.
t – tempo de passagem da corrente pelo eletrólito.
Temos:
Conceito de faraday (F)
A quantidade de eletricidade de 1 mol de elétrons (6,02 x 1023 elétrons) é chamada de faraday (F).
A carga elétrica que um elétron transporta é 1,6 x 10-19C.
Um mol de elétrons terá carga:
6,02 x 1023 x 1,6 x 10-19C
965000 C = 1 Faraday
22. Leis de Faraday
1ª Lei de Faraday
A massa de substância eletrolisada é diretamente proporcional à carga elétrica que atravessa a solução.
2ª Lei de Faraday
A massa de substância eletrolisada é diretamente proporcional à massa molar e inversamente proporcional à valência (carga) do íon.
23. Cálculo das quantidades envolvidas em uma eletrolise
Vamos analisar o problema abaixo:
Calcule a intensidade de corrente que o gerador deve fornecer para que, após 16 minutos e 5 segundos de passagem da corrente por uma solução de CuSO4, sejam depositados 12,7 g de cobre no cátodo.
Dados:
Massa molar do cobre: 63,5 g/mol
Carga elétrica de 1 mol de elétrons (faraday) 96.500 C.
Resolução por estequiometria

24. Equivalente eletroquímico (ε)
A quantidade de substância eletrolisada ou depositada, quando ocorre a passagem de uma carga de 1 coulomb (C) pela solução, é denominada equivalente eletroquímico.
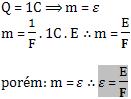
A quantidade de substância eletrolisada ou depositada, quando ocorre a passagem de uma carga de 1 coulomb (C) pela solução, é denominada equivalente eletroquímico.
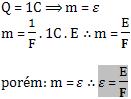
25. Cubas em serie
Lembrando que 1F eletrolisa 1E, se o circuito ocorrer em série, concluímos que, como a carga que circulará em cada eletrodo será a mesma, o número de equivalente formado também será o mesmo para todos os eletrodos.
Sabendo que a carga que passa nos eletrodos é a mesma:
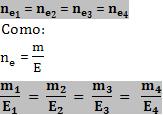
Esta aplicação pode ser feita para as pilhas. O número de equivalentes que aparece no cátodo é igual ao que desaparece no ânodo.
http://www.colegioweb.com.br/
Lembrando que 1F eletrolisa 1E, se o circuito ocorrer em série, concluímos que, como a carga que circulará em cada eletrodo será a mesma, o número de equivalente formado também será o mesmo para todos os eletrodos.
Sabendo que a carga que passa nos eletrodos é a mesma:
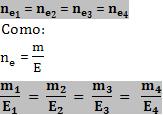
Esta aplicação pode ser feita para as pilhas. O número de equivalentes que aparece no cátodo é igual ao que desaparece no ânodo.
http://www.colegioweb.com.br/

Nenhum comentário:
Postar um comentário