1. Reação reversível
Reação reversível é aquela que pode ocorrer nos dois sentidos.
Reação direta: A + B → C + D
Se houver a possibilidade de os produtos reagirem entre si para formar os reagentes, nesse caso, teremos:
Reação inversa: C + D → A + B
Este fenômeno pode ser representado da seguinte forma:

Portanto, esta é uma reação reversível.
Exemplo:
Ao colocar no interior de um recipiente H2 e I2, depois de um tempo, notamos o surgimento de HI. Isto é, a reação entre H2 e I2 forma o HI.

Colocando em outro recipiente o HI, depois de um tempo, verificamos a presença de H2 e I2. Isto quer dizer que, a decomposição do HI forma o H2 e I2.
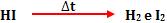
Portanto, esta é uma reação reversível.

Reação reversível é aquela que pode ocorrer nos dois sentidos.
Reação direta: A + B → C + D
Se houver a possibilidade de os produtos reagirem entre si para formar os reagentes, nesse caso, teremos:
Reação inversa: C + D → A + B
Este fenômeno pode ser representado da seguinte forma:
Portanto, esta é uma reação reversível.
Exemplo:
Ao colocar no interior de um recipiente H2 e I2, depois de um tempo, notamos o surgimento de HI. Isto é, a reação entre H2 e I2 forma o HI.
Colocando em outro recipiente o HI, depois de um tempo, verificamos a presença de H2 e I2. Isto quer dizer que, a decomposição do HI forma o H2 e I2.
Portanto, esta é uma reação reversível.
2. O estado de equilíbrio
Veja a seguir a evolução de uma reação reversível, para facilitar a compreensão do estado de equilíbrio.
Considere os reagentes de cor vermelha e os produtos de cor amarela.
Situação inicial
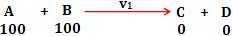
Coloração do sistema: vermelha
Iniciamos, por exemplo, com 100 moléculas de cada reagente. Nesse momento inicial, no qual as moléculas são colocadas em contato, não há produtos no sistema, portanto sua cor é totalmente vermelha.
Depois de certo tempo...

Coloração do sistema: o vermelho já se parece com o laranja
A reação é desencadeada. Os reagentes começam a se converter em produtos. Os reagentes são consumidos. E os produtos são formados. Com algumas moléculas se transformando em produto, pode ocorrer a reação inversa, ou seja, algumas moléculas de C e D podem se transformar novamente em A e B.
Com o surgimento do produto, a cor do sistema começa a ser alterada.
Definimos:
v1: velocidade da reação direta
v2: velocidade da reação inversa
Depois de mais um tempo...

Coloração do sistema: predominância da cor laranja
Ambas as reações não cessam. Porém, a velocidade da reação direta já é menor, e a velocidade da reação inversa só aumenta. O sistema em que ocorre a reação mostra aspectos evidentes de reação decorrendo.
O tempo continua passando...

Coloração do sistema: a cor laranja tende ao amarelo
A reação direta perdeu a sua velocidade pouco a pouco, enquanto reação inversa ganhava mais velocidade. O sistema em que ocorre a reação mostra que, gradualmente, houve um declínio dos sintomas de reação ocorrendo.
Algum tempo depois...

Coloração do sistema: amarelo-avermelhado
Algum tempo depois...

Insistindo, mais um tempo...

Coloração do sistema: a mesma do sistema anterior
Não ocorreram mais alterações no sistema. Aparentemente tudo parou, e o sistema não apresenta mais sinais de reação química. Portanto, o equilíbrio químico foi obtido.
Veja a seguir a evolução de uma reação reversível, para facilitar a compreensão do estado de equilíbrio.
Considere os reagentes de cor vermelha e os produtos de cor amarela.
Situação inicial
Coloração do sistema: vermelha
Iniciamos, por exemplo, com 100 moléculas de cada reagente. Nesse momento inicial, no qual as moléculas são colocadas em contato, não há produtos no sistema, portanto sua cor é totalmente vermelha.
Depois de certo tempo...
Coloração do sistema: o vermelho já se parece com o laranja
A reação é desencadeada. Os reagentes começam a se converter em produtos. Os reagentes são consumidos. E os produtos são formados. Com algumas moléculas se transformando em produto, pode ocorrer a reação inversa, ou seja, algumas moléculas de C e D podem se transformar novamente em A e B.
Com o surgimento do produto, a cor do sistema começa a ser alterada.
Definimos:
v1: velocidade da reação direta
v2: velocidade da reação inversa
Depois de mais um tempo...
Coloração do sistema: predominância da cor laranja
Ambas as reações não cessam. Porém, a velocidade da reação direta já é menor, e a velocidade da reação inversa só aumenta. O sistema em que ocorre a reação mostra aspectos evidentes de reação decorrendo.
O tempo continua passando...
Coloração do sistema: a cor laranja tende ao amarelo
A reação direta perdeu a sua velocidade pouco a pouco, enquanto reação inversa ganhava mais velocidade. O sistema em que ocorre a reação mostra que, gradualmente, houve um declínio dos sintomas de reação ocorrendo.
Algum tempo depois...
Coloração do sistema: amarelo-avermelhado
Algum tempo depois...
Insistindo, mais um tempo...
Coloração do sistema: a mesma do sistema anterior
Não ocorreram mais alterações no sistema. Aparentemente tudo parou, e o sistema não apresenta mais sinais de reação química. Portanto, o equilíbrio químico foi obtido.
3. Características do equilíbrio
• No equilíbrio, a velocidade da reação direta (v1) é a mesma velocidade da reação inversa (v2).
• O equilíbrio químico é um equilíbrio dinâmico.
• A impressão externa é de que tudo cessa, mas isso não ocorre. Tanto a reação direta como a inversa permanecem contínuas e sem interrupções, no entanto, com a mesma velocidade. A igualdade das velocidades direta e inversa mantém o equilíbrio químico contínuo.
• Como resultado disso, as concentrações de todas as substâncias presentes permanecem constantes no decorrer do tempo.
• Qualquer reação reversível tende, naturalmente, ao equilíbrio, pois ao atingir o equilíbrio o sistema consome menos energia. E assim permanece, a não ser que algum fator externo interfira nessa situação.
• Portanto, o equilíbrio químico é obtido apenas nas reações que ocorrem em sistema fechado, onde não há a introdução ou remoção de matéria ou de energia.
• Macroscopicamente tudo cessa, ou seja, a aparência externa do estado de equilíbrio mostra que tudo parou, no entanto, sabemos que microscopicamente (no plano molecular) ambas as reações continuam ocorrendo, com a mesma velocidade.
4. Exemplos de equilíbrio químico
1) Considere a reação reversível :
O hidrogênio e o iodo são colocados num recipiente fechado.
Quando certa quantidade de iodeto de hidrogênio é formada, a decomposição é iniciada, constituindo o iodo e o hidrogênio.
Quando a velocidade das reações direta e inversa estiverem iguais, dizemos que o equilíbrio químico foi obtido.
Durante a reação, os reagentes não são totalmente consumidos. Quando o processo termina, há uma mistura em equilíbrio, contendo tanto produtos como reagentes.
2) Equilíbrio entre água líquida e gasosa
Considere uma amostra de água líquida no interior de um recipiente fechado, sob temperatura constante, uma parte é convertida em vapor. Em seguida, o equilíbrio é obtido:
Tanto a vaporização quanto a condensação ocorrem sob a mesma velocidade, e as quantidades relativas de líquido e vapor permanecem constantes no decorrer do tempo.
No equilíbrio, sob 100°C, a concentração do vapor d’água é de 0, 0327mol/L e a pressão é de 1,00 atm.
5. Analise gráfica do equilíbrio
Vamos fazer a representação gráfica do que aprendemos até o momento sobre equilíbrio químico.
Vamos colocar as velocidades da reação direta (v1) e inversa (v2) em ordenadas, e o tempo na abscissa.
No início, a velocidade da reação inversa (v2) está zerada, enquanto a velocidade da reação direta (v1) é máxima. Com o passar do tempo, a velocidade da reação inversa aumenta enquanto a velocidade da reação direta diminui. No instante te, a velocidade das duas reações são igualadas, e o equilíbrio é obtido.

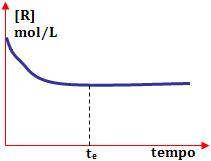
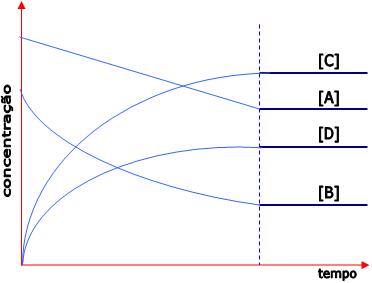
Podemos obter outros gráficos, ao colocar na ordenada as concentrações de reagentes [R], ou produtos [P] ou ambos, e o tempo na abscissa.
No início, a concentração de reagente é máxima. No decorrer do tempo, ela vai reduzindo até o instante te, onde torna-se constante e assim permanece. Neste momento, o equilíbrio é obtido.
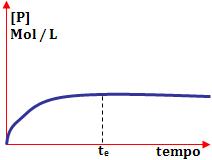
No início, a concentração do produto está zerada. No decorrer do tempo, ele aumenta até o instante te, onde torna-se constante e assim permanece. Neste momento, o equilíbrio é obtido.
Quando falamos em situação de equilíbrio referente às concentrações de reagente e produtos, ela pode ser de três tipos:
1º) Ao obter o equilíbrio, a concentração de reagente é maior do que a de produto:
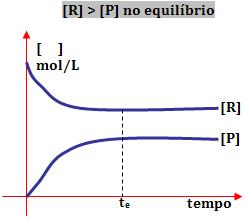
Este tipo de reação ocorre com maior extensão no sentido de formação dos reagentes.
2º) Ao obter o equilíbrio a concentração do produto é maior do que a de reagente:
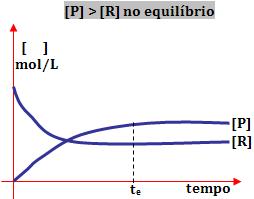
Este tipo de reação ocorre com maior extensão no sentido de formação dos produtos.
3º) Ao obter o equilíbrio, a concentração de reagente e a de produto é igual:
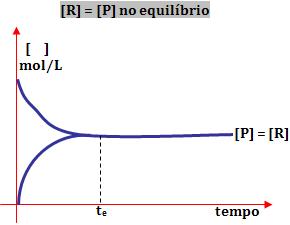
Tanto a reação direta como a reação inversa ocorre na mesma intensidade.
Vamos fazer a representação gráfica do que aprendemos até o momento sobre equilíbrio químico.
Vamos colocar as velocidades da reação direta (v1) e inversa (v2) em ordenadas, e o tempo na abscissa.
No início, a velocidade da reação inversa (v2) está zerada, enquanto a velocidade da reação direta (v1) é máxima. Com o passar do tempo, a velocidade da reação inversa aumenta enquanto a velocidade da reação direta diminui. No instante te, a velocidade das duas reações são igualadas, e o equilíbrio é obtido.

Podemos obter outros gráficos, ao colocar na ordenada as concentrações de reagentes [R], ou produtos [P] ou ambos, e o tempo na abscissa.
No início, a concentração de reagente é máxima. No decorrer do tempo, ela vai reduzindo até o instante te, onde torna-se constante e assim permanece. Neste momento, o equilíbrio é obtido.

No início, a concentração do produto está zerada. No decorrer do tempo, ele aumenta até o instante te, onde torna-se constante e assim permanece. Neste momento, o equilíbrio é obtido.

Quando falamos em situação de equilíbrio referente às concentrações de reagente e produtos, ela pode ser de três tipos:
1º) Ao obter o equilíbrio, a concentração de reagente é maior do que a de produto:

Este tipo de reação ocorre com maior extensão no sentido de formação dos reagentes.
2º) Ao obter o equilíbrio a concentração do produto é maior do que a de reagente:

Este tipo de reação ocorre com maior extensão no sentido de formação dos produtos.
3º) Ao obter o equilíbrio, a concentração de reagente e a de produto é igual:

Tanto a reação direta como a reação inversa ocorre na mesma intensidade.
6. Estado estacionário
O equilíbrio só ocorre em sistema fechado. Quando o sistema é aberto é possível que algumas das propriedades permaneçam constantes, apesar disso, sem o equilíbrio. Então, dizemos que o sistema está em estado estacionário.
Exemplo de estado estacionário
• Chama do bico de Bunsen
Em cada local da chama a temperatura é constante, ou seja, mesmo com o decorrer do tempo ela não varia. Entretanto, a chama do bico de bunsen não está em equilíbrio. A chama recebe incessantemente metano (CH4) e oxigênio (O2), e simultaneamente a chama libera dióxido de carbono (CO2) e água (H2O). Aliás, a temperatura é diferente em cada parte do sistema.
O equilíbrio só ocorre em sistema fechado. Quando o sistema é aberto é possível que algumas das propriedades permaneçam constantes, apesar disso, sem o equilíbrio. Então, dizemos que o sistema está em estado estacionário.
Exemplo de estado estacionário
• Chama do bico de Bunsen

Em cada local da chama a temperatura é constante, ou seja, mesmo com o decorrer do tempo ela não varia. Entretanto, a chama do bico de bunsen não está em equilíbrio. A chama recebe incessantemente metano (CH4) e oxigênio (O2), e simultaneamente a chama libera dióxido de carbono (CO2) e água (H2O). Aliás, a temperatura é diferente em cada parte do sistema.
7. Análise quantitativa do equilíbrio – a constante de equilíbrio
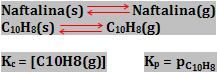
Sabemos que ao obter o equilíbrio, as concentrações de todas as substâncias do sistema ficam constantes. Para relacionar essas concentrações no equilíbrio, para prever a extensão com que a reação ocorre em cada sentido, vamos apresentar uma constante de equilíbrio.
Considere a reação reversível a seguir e a, b, c, d como os seus respectivos coeficientes:
v1 = k1 [A]a . [B]b
v2 = k2 [C]c . [D]d
Do mesmo modo que no equilíbrio v1 = v2, temos:
k1 [A]a . [B]b = k2 [C]c . [D]d
Transmitindo as constantes para o mesmo lado, fazemos, por convenção, k1/k2.
Do mesmo modo que a relação entre duas constante é uma terceira constante, ocorre:
que é a expressão da constante de equilíbrio.
8. Tipos de constante de equilíbrio
Podemos expressar a constante de equilíbrio de duas maneiras:
Kc: constante de equilíbrio expressa em função de quantidade de matéria (mol/L).
Kp: constante de equilíbrio expressa em função das expressões parciais.
Apresentamos a constante Kc colocando na fórmula os valores das concentrações, em mol/L, no equilíbrio.
Apresentamos a constante Kp colocando na fórmula os valores das pressões parciais dos gases presentes no equilíbrio (em atm ou mmHg).
Exemplos de aplicação das constantes 1)

2)

3)

Na expressão Kc não participam substâncias sólidas, somente concentrações que podem sofrer variações, como a concentração de uma substância em solução e a concentração de um gás.
Na expressão Kp somente participam substâncias gasosas.
4)

5)

6)
Todas as reações químicas possuem um determinado valor para cada constante de equilíbrio. Tal valor depende da temperatura.
Portanto, podemos dizer que, a constante de equilíbrio depende da reação química e da temperatura.
Logo,
Só ocorrerá alterações nas constantes Kc e Kp, quando ocorrer variações na temperatura.
9. Alguns valores numéricos da constante de equilíbrio
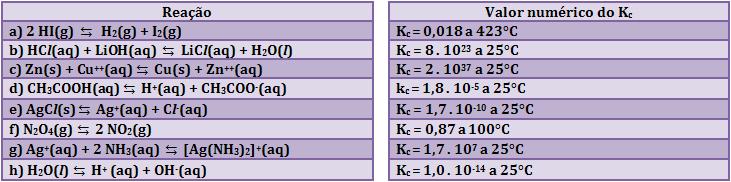
Em todos os exemplos, a relação das concentrações dos produtos e reagentes consiste em uma constante de equilíbrio.
Quando K for menor que 1, a concentração do reagente será predominante, isto significa que, no aspecto de formação dos produtos, a reação ocorre numa curta extensão. Quando K for maior, a formação do produto tem preferência, isto significa que, no aspecto de formação dos produtos, a reação ocorre numa grande extensão.
Quando K for igual à 1 (pouco provável), a concentração do produto será igual à do reagente.
Conclusão:
O valor numérico da constante de equilíbrio de uma reação é uma expressão da tendência de os reagentes se transformarem em produtos.

Em todos os exemplos, a relação das concentrações dos produtos e reagentes consiste em uma constante de equilíbrio.
Quando K for menor que 1, a concentração do reagente será predominante, isto significa que, no aspecto de formação dos produtos, a reação ocorre numa curta extensão. Quando K for maior, a formação do produto tem preferência, isto significa que, no aspecto de formação dos produtos, a reação ocorre numa grande extensão.
Quando K for igual à 1 (pouco provável), a concentração do produto será igual à do reagente.
Conclusão:
O valor numérico da constante de equilíbrio de uma reação é uma expressão da tendência de os reagentes se transformarem em produtos.
10. Unidade das constantes de equilíbrio
A unidade das constantes de equilíbrio está diretamente relacionada com a unidade utilizada nas substâncias participantes. Existem algumas constantes que não possuem unidade.
Exemplos de cálculos de unidades
1)

2)
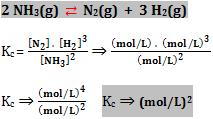
3)

A unidade das constantes de equilíbrio está diretamente relacionada com a unidade utilizada nas substâncias participantes. Existem algumas constantes que não possuem unidade.
Exemplos de cálculos de unidades
1)

2)
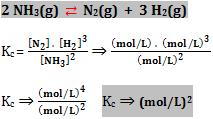
3)

11. Relação entre Kp e Kc
Podemos calcular o Kp a partir do Kc, estabelecendo a seguinte reação:
Sendo que:
Kp = constante de equilíbrio em termos de pressão parcial.
Kc = constante de equilíbrio em termos de concentração.
R = constante geral dos gases perfeitos. (0,082 atm . L/K . mol).
T = temperatura absoluta (kelvin).
∆H = variação da quantidade de matéria da reação, levando em conta apenas os gases.
Observação:
O cálculo do ∆n ocorre a partir dos coeficientes da reação.
(quantidade em mols final – quantidade em mols inicial)
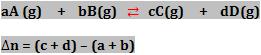
Exemplos de calculo de ∆n
1)
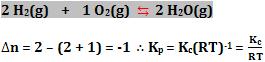
2)
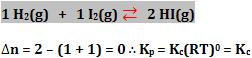
3)
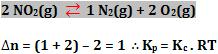
12. Calculo das quantidades no equilíbrio Considere a seguinte situação:
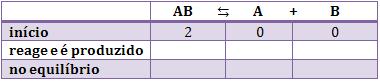
Num recipiente de 2 litros colocamos 2 mols de uma substância AB. Ao obter o equilíbrio, observamos a presença de 0,5 mol de B.
Vamos definir o Kc da reação:
Resolução:
O cálculo da constante de equilíbrio só pode ser realizado com as concentrações no equilíbrio. Porém, neste problema, só conhecemos a quantidade inicial e uma quantidade no equilíbrio. Então, vamos utilizar o quadro abaixo para resolver este problema:
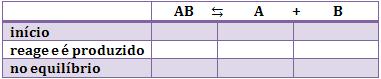
A primeira linha será preenchida com as quantidades iniciais. É claro que na quantidade inicial não há produtos, somente reagentes. Portanto, não há nada de A e B e o quadro inicia da seguinte forma:
Sabemos que no equilíbrio há 0,5 mol de B, portanto colocamos esse dado na terceira linha. Sabemos que no início não havia nada, então concluímos que no decorrer da reação foi produzido 0,5 mol de B. Portanto, evidentemente colocamos 0,5 na segunda linha.
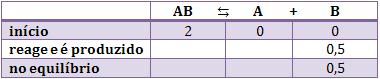
Para completar a segunda linha, vamos usar a regra de três com os coeficientes das substâncias participantes. Esse processo é lógico, pois sabemos que 0,5 mol de B foi produzido, e a partir daí, podemos descobrir quanto de A foi produzido e quanto de AB foi consumido.
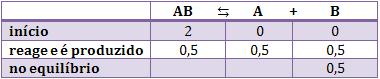
Veja a demonstração da regra de 3:
Quando for reagente iremos subtrair, e somar quando for produto, pois os reagentes foram consumidos e os produtos foram formados.
Portanto, o quadro ficará assim:
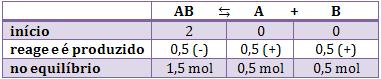
Agora que já sabemos as quantidades de equilíbrio, vamos dividir todas pelo volume (em litros), obteremos as respectivas concentrações (em mol/litro) e faremos a substituição na fórmula:

15. O sistema esta ou não em equilíbrio?
Seja o equilíbrio:
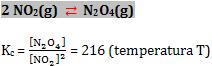
Considere três sistemas contidos de uma mistura dos gases N2O4 (incolor) e NO2 (vermelho) com as concentrações assinaladas.
Agora veja como devemos fazer para saber se o sistema está em equilíbrio ou não:
- Defina o quociente das concentrações, Q:
- Vamos fazer o cálculo do quociente das concentrações para os três sistemas:
Sistema I
Conclusão: O sistema não atingiu o equilíbrio, pois Q < Kc. O quociente Q deve ficar maior, isto significa que, NO2 será consumido e outros N2O4 serão formados.
Sistema II
Conclusão: O sistema está em equilíbrio, pois Q = Kc. As concentrações permanecem constantes.
Sistema III
Conclusão: O sistema não está em equilíbrio, pois Q > Kc. O quociente Q deve ficar menor, isto significa que, N2O4 será consumido e mais NO2 será formado.
http://www.colegioweb.com.br/quimica
DESLOCAMENTO DO EQUILÍBRIO:
1. O que significa deslocar um equilíbrio?
Deslocar um equilíbrio químico significa fazer que a velocidade da reação direta fique diferente da velocidade da reação inversa (v1 ≠ v2).
Nesse caso, existem duas situações possíveis:
v1 > v2
Isto é, a reação direta é mais intensa. Então, podemos dizer que o equilíbrio foi deslocado no sentido de formação dos produtos.
v1 < v2
Isto é, a reação inversa é mais intensa. Então, podemos dizer que o equilíbrio foi deslocado no sentido de formação dos reagentes.
2. Fatores que deslocam um equilíbrio
Fatores capazes de deslocar o equilíbrio:
1. Concentração
2. Temperatura
3. Pressão
Princípio regedor do deslocamento do equilíbrio químico: Princípio de Le Chatelier, publicado em 1884, e também conhecido como Princípio da Fuga ante a Força.
“Quando um sistema em equilíbrio sofre a ação de forças externas, o sistema tende a se deslocar no sentido de minimizar a ação da força aplicada, procurando uma nova situação de equilíbrio.”
Fatores capazes de deslocar o equilíbrio:
1. Concentração
2. Temperatura
3. Pressão
Princípio regedor do deslocamento do equilíbrio químico: Princípio de Le Chatelier, publicado em 1884, e também conhecido como Princípio da Fuga ante a Força.
“Quando um sistema em equilíbrio sofre a ação de forças externas, o sistema tende a se deslocar no sentido de minimizar a ação da força aplicada, procurando uma nova situação de equilíbrio.”
3. Efeito da concentração
Lei de Guldberg-Waage: A velocidade de uma reação é diretamente proporcional à concentração dos reagentes.
O aumento da concentração de uma substância presente no equilíbrio faz que o equilíbrio se desloque no sentido de consumir a substância adicionada, isto é, o equilíbrio se desloca para o lado contrário ao aumento. Já a diminuição de uma substância presente no equilíbrio faz que o equilíbrio se desloque no sentido de repor a substância retirada, isto é, o equilíbrio se desloca para o mesmo lado da diminuição.
Observações:
1. Substância sólida não desloca um equilíbrio químico, pois a concentração de um sólido em termos de velocidade é considerada constante, porque a reação se dá na superfície do sólido.
2. Substância líquida em excesso não desloca o equilíbrio químico quando alterada a sua concentração, pois a concentração de um líquido em excesso em termos de velocidade é considerada constante, porque o líquido em excesso não é fator limitante da reação.
3. Pulverizando uma substância sólida, o equilíbrio desloca-se para o lado contrário a pulverização, pois aumenta a superfície de contato, aumenta o número de colisões efetivas e, conseqüentemente, aumenta a velocidade da reação.
4. Alterando-se a concentração de uma substância presente no equilíbrio, o equilíbrio desloca-se, porém sua constante de equilíbrio permanece inalterada (a constante permanece constante).
Resumindo:
Aumentando a concentração, o equilíbrio desloca-se para o lado contrário ao aumento.
Diminuindo a concentração, o equilíbrio desloca-se para o mesmo lado da diminuição.
Exemplo:
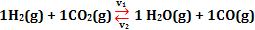
Ao aumentarmos a concentração molar de
H2(g) = [H2(g)] = v1 = desloca para direita.
Ao diminuirmos a concentração molar de
H2(g) = [H2(g)] = v1 = desloca para esquerda.
Ao aumentarmos a concentração molar de
H2O(g) = [H2O(g)] = v2 = desloca para esquerda.
Ao diminuirmos a concentração molar de
H2O(g) = [H2O(g)] = v2 = desloca para direita.
Observação – O efeito do íon comum: num equilíbrio iônico, a adição de uma substância que produz um íon igual a um dos existentes no sistema irá provocar deslocamento do equilíbrio no sentido de consumo deste íon.
Lei de Guldberg-Waage: A velocidade de uma reação é diretamente proporcional à concentração dos reagentes.
O aumento da concentração de uma substância presente no equilíbrio faz que o equilíbrio se desloque no sentido de consumir a substância adicionada, isto é, o equilíbrio se desloca para o lado contrário ao aumento. Já a diminuição de uma substância presente no equilíbrio faz que o equilíbrio se desloque no sentido de repor a substância retirada, isto é, o equilíbrio se desloca para o mesmo lado da diminuição.
Observações:
1. Substância sólida não desloca um equilíbrio químico, pois a concentração de um sólido em termos de velocidade é considerada constante, porque a reação se dá na superfície do sólido.
2. Substância líquida em excesso não desloca o equilíbrio químico quando alterada a sua concentração, pois a concentração de um líquido em excesso em termos de velocidade é considerada constante, porque o líquido em excesso não é fator limitante da reação.
3. Pulverizando uma substância sólida, o equilíbrio desloca-se para o lado contrário a pulverização, pois aumenta a superfície de contato, aumenta o número de colisões efetivas e, conseqüentemente, aumenta a velocidade da reação.
4. Alterando-se a concentração de uma substância presente no equilíbrio, o equilíbrio desloca-se, porém sua constante de equilíbrio permanece inalterada (a constante permanece constante).
Resumindo:
Aumentando a concentração, o equilíbrio desloca-se para o lado contrário ao aumento.
Diminuindo a concentração, o equilíbrio desloca-se para o mesmo lado da diminuição.
Exemplo:
Ao aumentarmos a concentração molar de
H2(g) = [H2(g)] = v1 = desloca para direita.
Ao diminuirmos a concentração molar de
H2(g) = [H2(g)] = v1 = desloca para esquerda.
Ao aumentarmos a concentração molar de
H2O(g) = [H2O(g)] = v2 = desloca para esquerda.
Ao diminuirmos a concentração molar de
H2O(g) = [H2O(g)] = v2 = desloca para direita.
Observação – O efeito do íon comum: num equilíbrio iônico, a adição de uma substância que produz um íon igual a um dos existentes no sistema irá provocar deslocamento do equilíbrio no sentido de consumo deste íon.
4. Efeito da temperatura
A temperatura favorece tanto a velocidade da reação endotérmica quanto a velocidade da reação exotérmica, porém favorece muito mais a velocidade da reação endotérmica. Assim, ao aumentarmos a temperatura de um sistema em equilíbrio, o equilíbrio desloca-se no sentido da reação endotérmica porque é a reação mais favorecida com o aumento da temperatura. Já a diminuição da temperatura de um sistema em equilíbrio faz que o equilíbrio se desloque no sentido da reação exotérmica, porque é a reação menos prejudicada com a diminuição da temperatura.
Observações:
1. Quando o H for fornecido, sempre faz referência à reação direta.
2. Alterando-se a temperatura de um sistema em equilíbrio, o equilíbrio desloca-se, e seu estado de equilíbrio altera-se surgindo uma nova constante de equilíbrio, pois a temperatura é o único fator capaz de alterar a constante de equilíbrio.
3. Lei de Van’t Hoof: “A cada aumento de 10°C na temperatura de uma reação química, a velocidade da reação duplica ou até mesmo triplica.”
Nota:
Van’t Hoof não considerou que cada reação tem um ótimo de temperatura para ocorrer (temperatura ideal) e após atingido esse ótimo, o aumento da temperatura pode não mais influenciar a velocidade da reação ou até mesmo prejudicá-la.
Exemplo: Reações Enzimáticas.
Resumindo:
Aumentando a temperatura, o equilíbrio desloca-se para o lado endotérmico. (mais favorecido com o aumento da temperatura).
Diminuindo a temperatura, o equilíbrio desloca-se para o lado exotérmico. (menos prejudicado com a diminuição da temperatura).
A temperatura favorece tanto a velocidade da reação endotérmica quanto a velocidade da reação exotérmica, porém favorece muito mais a velocidade da reação endotérmica. Assim, ao aumentarmos a temperatura de um sistema em equilíbrio, o equilíbrio desloca-se no sentido da reação endotérmica porque é a reação mais favorecida com o aumento da temperatura. Já a diminuição da temperatura de um sistema em equilíbrio faz que o equilíbrio se desloque no sentido da reação exotérmica, porque é a reação menos prejudicada com a diminuição da temperatura.
Observações:
1. Quando o H for fornecido, sempre faz referência à reação direta.
2. Alterando-se a temperatura de um sistema em equilíbrio, o equilíbrio desloca-se, e seu estado de equilíbrio altera-se surgindo uma nova constante de equilíbrio, pois a temperatura é o único fator capaz de alterar a constante de equilíbrio.
3. Lei de Van’t Hoof: “A cada aumento de 10°C na temperatura de uma reação química, a velocidade da reação duplica ou até mesmo triplica.”
Nota:
Van’t Hoof não considerou que cada reação tem um ótimo de temperatura para ocorrer (temperatura ideal) e após atingido esse ótimo, o aumento da temperatura pode não mais influenciar a velocidade da reação ou até mesmo prejudicá-la.
Exemplo: Reações Enzimáticas.
Resumindo:
Aumentando a temperatura, o equilíbrio desloca-se para o lado endotérmico. (mais favorecido com o aumento da temperatura).
Diminuindo a temperatura, o equilíbrio desloca-se para o lado exotérmico. (menos prejudicado com a diminuição da temperatura).
5. Efeito da pressão
Lei de Boyle-Mariotte:
“À temperatura constante, um aumento de pressão favorece a contração de volume”
“O aumento da pressão sobre um sistema em equilíbrio faz que o equilíbrio desloque-se, ou seja, o equilíbrio desloca-se para o lado de menor volume. Já a diminuição da pressão sobre um sistema em equilíbrio faz que o equilíbrio se desloque no sentido da expansão volumétrica, ou seja, o equilíbrio desloca-se para o lado de maior volume”.
Observações:
1. A pressão só influencia participantes gasosos, pois sólidos e líquidos são incompressíveis.
2. Segundo Gay–Lussac, pressão e volume são grandezas inversamente proporcionais.
3. O volume de um sistema em equilíbrio é dado pela soma dos coeficientes estequiométricos dos gases no referido lado do equilíbrio na reação devidamente balanceada.
4. Alterando-se a pressão sobre um sistema em equilíbrio, o equilíbrio desloca-se, porém sua constante de equilíbrio permanece inalterada (a constante permanece constante).
5. A adição de um gás inerte a um sistema em equilíbrio não desloca o equilíbrio químico, desde que o êmbolo esteja fixo, pois o gás inerte não altera as pressões parciais no equilíbrio porque ele não reage com nenhum dos participantes do equilíbrio.
6. Efeito dos catalisadores
Ao colocar um catalisador num sistema em equilíbrio, ele provocará um aumento na velocidade das reações direta e inversa.
Portanto, ao introduzir um catalisador no início de uma reação ocorrerá uma alteração no tempo em que o equilíbrio é obtido, porém não irá interferir na composição final do equilíbrio, ou seja, não provocará alteração na concentração das substâncias participantes.
Conclusão:
O catalisador não provoca o deslocamento do equilíbrio químico, ele apenas altera o tempo em que o equilíbrio é obtido, ou seja, fazendo com que o equilíbrio seja alcançado com mais rapidez.
7. Observação importante
A pressão e a concentração provocam o deslocamento do equilíbrio, porém não alteram o valor de Kc e Kp. Somente a temperatura é capaz de deslocar o equilíbrio e alterar o valor de Kc e Kp.
Exemplo:
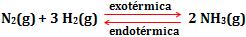
Ao aumentar a temperatura ocorre o deslocamento do equilíbrio no sentido de formação dos reagentes (endotérmica). Portanto, ocorre o aumento da concentração de N2 e H2 e a diminuição da concentração do NH3. Diminui o valor de Kc.
http://www.colegioweb.com.br/
A pressão e a concentração provocam o deslocamento do equilíbrio, porém não alteram o valor de Kc e Kp. Somente a temperatura é capaz de deslocar o equilíbrio e alterar o valor de Kc e Kp.
Exemplo:
Ao aumentar a temperatura ocorre o deslocamento do equilíbrio no sentido de formação dos reagentes (endotérmica). Portanto, ocorre o aumento da concentração de N2 e H2 e a diminuição da concentração do NH3. Diminui o valor de Kc.

Nenhum comentário:
Postar um comentário