1. Equilíbrio iônico
Trata-se de um sistema em equilíbrio em que há pelo menos um íon no equilíbrio.
Podemos estudar os equilíbrios iônicos da mesma forma que estudamos os equilíbrios moleculares, porém devemos lembrar que existem alguns detalhes bem diferentes nos equilíbrio iônicos em relação aos outros equilíbrios.
Vamos citar com exemplo a ionização do ácido acético:
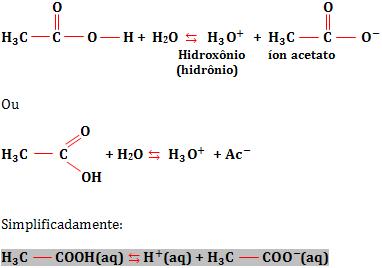
Neste caso, temos um equilíbrio homogêneo, em relação ao qual podemos aplicar, em linhas gerais, o mesmo raciocínio usado nos equilíbrios moleculares.
Trata-se de um sistema em equilíbrio em que há pelo menos um íon no equilíbrio.
Podemos estudar os equilíbrios iônicos da mesma forma que estudamos os equilíbrios moleculares, porém devemos lembrar que existem alguns detalhes bem diferentes nos equilíbrio iônicos em relação aos outros equilíbrios.
Vamos citar com exemplo a ionização do ácido acético:

Neste caso, temos um equilíbrio homogêneo, em relação ao qual podemos aplicar, em linhas gerais, o mesmo raciocínio usado nos equilíbrios moleculares.
2. Constante de ionização (Ki)
Considere o equilíbrio abaixo:
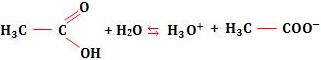
Agora vamos tirar o valor da constante desse equilíbrio:
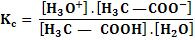
Sabendo que a água é o solvente, consideramos a concentração da água praticamente constante, para cada temperatura.
Portanto, [H2O] é constante, e do produto [H2O] . Kc temos outra constante, denominada constante de ionização (Ki).
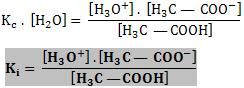
Podemos calcular a concentração da água da seguinte forma:
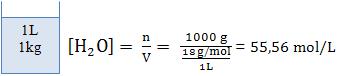
A constante de ionização só será alterada quando a temperatura variar.
Considere o equilíbrio abaixo:
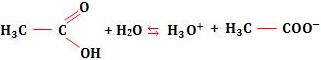
Agora vamos tirar o valor da constante desse equilíbrio:
Sabendo que a água é o solvente, consideramos a concentração da água praticamente constante, para cada temperatura.
Portanto, [H2O] é constante, e do produto [H2O] . Kc temos outra constante, denominada constante de ionização (Ki).
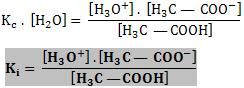
Podemos calcular a concentração da água da seguinte forma:
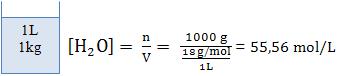
A constante de ionização só será alterada quando a temperatura variar.
3. Constante de ionização de ácidos e bases
A constante de ionização de um ácido é comumente representada por Ka, e a de uma base por Kb.
Veja nos exemplos abaixo, os valores de Ki foram determinados a 25°C.
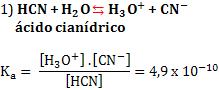
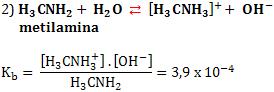
4. Grau de ionização (α)
Se colocarmos 1 mol de HCl em 1 litro de água, podemos verificar que, para cada 1 000 moléculas de HCl dissolvidas, 920 sofrem ionização e 80 não ionizam.
Se colocarmos 1 mol de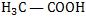 em 1 litro de água, podemos verificar que, para cada 1000 moléculas de
em 1 litro de água, podemos verificar que, para cada 1000 moléculas de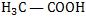 dissolvidas, 13 sofrem ionização e 987 não ionizam.
dissolvidas, 13 sofrem ionização e 987 não ionizam.
Para calcular o valor numérico do grau de ionização (α) pela seguinte relação:
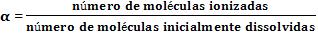
Desse modo, para o HCl e o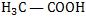 , o grau de ionização vale:
, o grau de ionização vale:
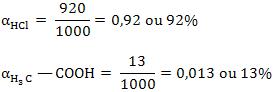
Se colocarmos 1 mol de HCl em 1 litro de água, podemos verificar que, para cada 1 000 moléculas de HCl dissolvidas, 920 sofrem ionização e 80 não ionizam.
Se colocarmos 1 mol de
Para calcular o valor numérico do grau de ionização (α) pela seguinte relação:
Desse modo, para o HCl e o
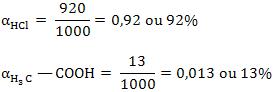
5. Ácidos polipróticos
Ácidos polipróticos são aqueles que apresentam mais de um hidrogênio ionizável. A ionização ocorre por etapas, ou seja, o ácido cede um próton (H+) por vez.
Exemplo:
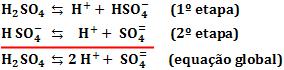
O primeiro próton sai com mais facilidade do que o segundo, pois este é retirado de um íon negativo, portanto é necessário dominar a atração elétrica entre o próton e o ânion. Logo, podemos dizer que, H2SO4 é um ácido mais forte que
Considere:
α1 – grau de ionização na 1ª etapa.
K1 – constante de ionização na 1º etapa.
α2 – grau de ionização na 2º etapa.
K2 – constante de ionização na 2º etapa.
Logo, temos:
α1 > α2 e K1 > K2
Veja a expressão de K1 e K2:
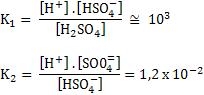
Se multiplicarmos membro a membro, temos:
Sendo Kn a constante de ionização associada à equação global, temos, portanto:
Kn = K1 . K2
6. Lei de Diluição de Ostwald
Tomemos novamente o exemplo do ácido acético. Considere uma solução do ácido de M mols/litro, ou seja, a concentração em mol/L é igual a M.
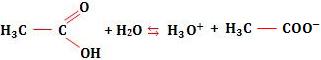
Temos:

Sendo α o grau de ionização do ácido, ocorrerá ionização de α M mols/litro do ácido, com formação de α M mols/litro de H3O+ e α M mols/litro de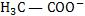 .
.
Se tínhamos M mols/litro do ácido e se ocorreu ionização de α M mols/litro, restaram (M – α M) mols/litro do ácido no equilíbrio.
Se aplicarmos a expressão de Ki para este equilíbrio, temos:
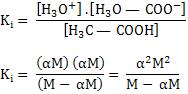
Se dividirmos por M o numerador e denominador, teremos:
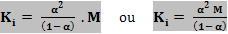
Conclusão:
Quando a concentração M aumenta, o denominador (1 – α) deverá aumentar proporcionalmente, garantindo o valor constante de K1. Isto é, quando a concentração aumenta, α diminui, tendendo a zero, e se a concentração diminui, (1 – α) também deve diminuir, ou seja, α deve tender a 1.
Esta conclusão explica a Lei de Diluição de Ostwald:
“A uma dada temperatura, o aumento da concentração provoca diminuição do grau de ionização e, ao contrário, a diminuição da concentração provoca aumento do grau de ionização.”
Tomemos novamente o exemplo do ácido acético. Considere uma solução do ácido de M mols/litro, ou seja, a concentração em mol/L é igual a M.
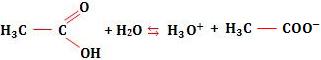
Temos:
Sendo α o grau de ionização do ácido, ocorrerá ionização de α M mols/litro do ácido, com formação de α M mols/litro de H3O+ e α M mols/litro de
Se tínhamos M mols/litro do ácido e se ocorreu ionização de α M mols/litro, restaram (M – α M) mols/litro do ácido no equilíbrio.
Se aplicarmos a expressão de Ki para este equilíbrio, temos:
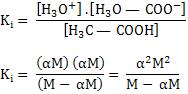
Se dividirmos por M o numerador e denominador, teremos:
Conclusão:
Quando a concentração M aumenta, o denominador (1 – α) deverá aumentar proporcionalmente, garantindo o valor constante de K1. Isto é, quando a concentração aumenta, α diminui, tendendo a zero, e se a concentração diminui, (1 – α) também deve diminuir, ou seja, α deve tender a 1.
Esta conclusão explica a Lei de Diluição de Ostwald:
“A uma dada temperatura, o aumento da concentração provoca diminuição do grau de ionização e, ao contrário, a diminuição da concentração provoca aumento do grau de ionização.”
7. Repressão da ionização de um eletrólito fraco – efeito do íon comum
Tomemos mais uma vez o equilíbrio do ácido acético:
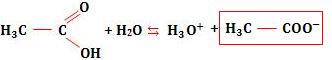
Considere que adicionamos à solução que contém ácido acético, um sal que contém íon acetato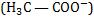 , ou seja, um íon comum.
, ou seja, um íon comum.
Veja o exemplo com acetato de sódio:
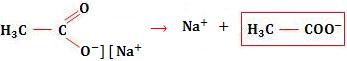
Ocorrerá o aumento da concentração de acetato, fazendo o equilíbrio se deslocar para a formação dos reagentes, conseqüentemente, a concentração de [H3O+] irá diminuir e a concentração de ácido acético não-dissociado aumentará.
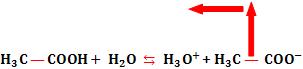
Conclusão:
A adição do íon comum causou:
a) aumento da concentração do
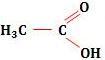
não dissociado.
b) diminuição da concentração do H3O+.
c) enfraquecimento do ácido, com diminuição de α (grau de dissociação).
http://www.colegioweb.com.br/quimica
Tomemos mais uma vez o equilíbrio do ácido acético:
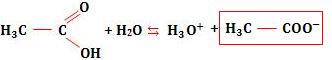
Considere que adicionamos à solução que contém ácido acético, um sal que contém íon acetato
Veja o exemplo com acetato de sódio:
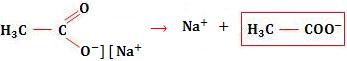
Ocorrerá o aumento da concentração de acetato, fazendo o equilíbrio se deslocar para a formação dos reagentes, conseqüentemente, a concentração de [H3O+] irá diminuir e a concentração de ácido acético não-dissociado aumentará.
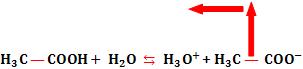
Conclusão:
A adição do íon comum causou:
a) aumento da concentração do

não dissociado.
b) diminuição da concentração do H3O+.
c) enfraquecimento do ácido, com diminuição de α (grau de dissociação).
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário