pH e pOH
1. Produto iônico da água
A água é um eletrólito muito fraco, com condutibilidade elétrica muito baixa.
A ionização da água ocorre conforme a equação abaixo:
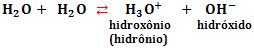
Considerando o que foi exposto acima, vamos colocar a constante de ionização para o equilíbrio anterior:
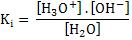
Como o grau de ionização da água é baixo, a concentração em mol/L da água, [H2O], é praticamente constante.
Sabendo que [H2O] é constante, o produto Ki . [H2O] também será constante, e denominado Kw, produto iônico da água.
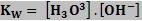
Kw só varia com a temperatura, com a mudança da temperatura ocorre a variação do valor numérico de Kw.
Quando a temperatura aumenta, a reação de ionização é favorecida, ou seja, as moléculas dissociam-se formando um número maior de íons. Logo, o produto das concentrações desses íons (Kw) aumenta.
A água é um eletrólito muito fraco, com condutibilidade elétrica muito baixa.
A ionização da água ocorre conforme a equação abaixo:
Considerando o que foi exposto acima, vamos colocar a constante de ionização para o equilíbrio anterior:
Como o grau de ionização da água é baixo, a concentração em mol/L da água, [H2O], é praticamente constante.
Sabendo que [H2O] é constante, o produto Ki . [H2O] também será constante, e denominado Kw, produto iônico da água.
Kw só varia com a temperatura, com a mudança da temperatura ocorre a variação do valor numérico de Kw.
Quando a temperatura aumenta, a reação de ionização é favorecida, ou seja, as moléculas dissociam-se formando um número maior de íons. Logo, o produto das concentrações desses íons (Kw) aumenta.
| TEMPERATURA | KW |
| 0°C | 0,12 x 10-14 |
| 15°C | 0,46 x 10-14 |
| 25°C | 1,0 x 10-14 |
| 50°C | 5,5 x 10-14 |
| 100°C | 51 x 10-14 |
2. Soluções ácidas, básicas e neutras
Água pura e solução neutra
A ionização de uma molécula de água gera um íon hidroxônio e um íon hidróxido. Logo, em água pura, a concentração hidrogeniônica é igual à concentração hidroxilônica.

Solução ácida
Ao dissolver um ácido na água ocorre o aumento da concentração hidrogeniônica.
Exemplo:
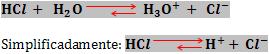
Sabendo que o produto [H+] .[OH–] é constante, se [H+] aumentar, logo [H–] diminui.
“Um meio é ácido quando [H+] > [OH–]”.
A 25°C, teremos em um meio ácido:
[H+] > 1 x 10-7 mol/L
[OH–] < 1 x 10-7 mol/L
Por exemplo, se num meio ácido em que, a 25°C, [H+] = 1 . 10-4 mol/L e [OH–] = 1 . 10-10 mol/L terá caráter ácido.
Solução básica ou alcalina
Ao dissolver uma base na água, ocorre um aumento da concentração hidroxiliônica.
Exemplo:

Sabendo que o produto [H+] . [OH–] é constante, se [OH–] aumentar, logo [H+] diminui.
“Um meio é básico ou alcalino quando [OH–] > [H+]”.
A 25° C, teremos em um meio ácido:
[OH–] > 1 . 10-7 mol/L
[H+] < 1 . 10-7 mol/L
Por exemplo, se num meio em que, a 25°C, [OH–] = 1 . 10-3 mol/L e [H+] = 1 . 10-11 mol/L terá caráter básico.
Resumidamente, a 25°C, temos:
soluções [H3O+] = 1 . 10-7 mol/L
neutras [OH–] = 1 . 10-7 mol/L
soluções [H3O+] > 1 . 10-7 mol/L
ácidas [OH–] < 1 . 10-7 mol/L
soluções [H3O+] < 1 . 10-7 mol/L
básicas [OH–] > 1 . 10-7 mol/L
Lembre-se que a 25°C:
[H3O+] . [OH–] = 1,0 x 10-14
Água pura e solução neutra
A ionização de uma molécula de água gera um íon hidroxônio e um íon hidróxido. Logo, em água pura, a concentração hidrogeniônica é igual à concentração hidroxilônica.

Solução ácida
Ao dissolver um ácido na água ocorre o aumento da concentração hidrogeniônica.
Exemplo:
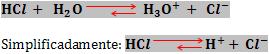
Sabendo que o produto [H+] .[OH–] é constante, se [H+] aumentar, logo [H–] diminui.
“Um meio é ácido quando [H+] > [OH–]”.
A 25°C, teremos em um meio ácido:
[H+] > 1 x 10-7 mol/L
[OH–] < 1 x 10-7 mol/L
Por exemplo, se num meio ácido em que, a 25°C, [H+] = 1 . 10-4 mol/L e [OH–] = 1 . 10-10 mol/L terá caráter ácido.
Solução básica ou alcalina
Ao dissolver uma base na água, ocorre um aumento da concentração hidroxiliônica.
Exemplo:
Sabendo que o produto [H+] . [OH–] é constante, se [OH–] aumentar, logo [H+] diminui.
“Um meio é básico ou alcalino quando [OH–] > [H+]”.
A 25° C, teremos em um meio ácido:
[OH–] > 1 . 10-7 mol/L
[H+] < 1 . 10-7 mol/L
Por exemplo, se num meio em que, a 25°C, [OH–] = 1 . 10-3 mol/L e [H+] = 1 . 10-11 mol/L terá caráter básico.
Resumidamente, a 25°C, temos:
soluções [H3O+] = 1 . 10-7 mol/L
neutras [OH–] = 1 . 10-7 mol/L
soluções [H3O+] > 1 . 10-7 mol/L
ácidas [OH–] < 1 . 10-7 mol/L
soluções [H3O+] < 1 . 10-7 mol/L
básicas [OH–] > 1 . 10-7 mol/L
Lembre-se que a 25°C:
[H3O+] . [OH–] = 1,0 x 10-14
3-
pH:
Sörensen definiu pH como sendo o logaritmo (decimal) do inverso da concentração hidrogeniônica:
pH = log 1/[H+]
Ou ainda, como o cologarítmo da concentração hidrogeniônica:
pH = colog [H+]
Ou seja:
pH = log 1/[H+] → pH = log 1 – log [H+]
Como log 1 = 0:
pH = -log[H+] ou pH = colog [H+]
que é igual ao inverso do log.
Vejamos a variação do pH em função das concentrações de H+ e OH-, a 25 °C:
Meio neutro: pH = 7
Meio ácido: pH < 7
Meio básico: pH > 7
pOH:
Por analogia, define-se pOH como sendo o logaritmo (decimal) do inverso da concentração hidroxiliônica:
pOH = log 1/[OH-]
Ou ainda, como sendo o cologaritmo da concentração de OH-:
pOH = colog [OH-]
Assim:
pOH = log 1/[OH-] → pOH = log 1 – log [OH-]
Como log 1 = 0:
pOH = -log[OH-] ou pOH = colog [OH-]
Vejamos a variação do pOH em função das concentrações de OH- e H+:
Meio neutro: pOH = 7
Meio ácido: pOH > 7
Meio básico: pOH < 7
Relação entre pH e pOH:
pH + pOH = 14 (25 °C)
Observação:
Os conceitos de pH e pOH indicam que em qualquer solução coexistem H+ e OH-. Por mais ácida que seja a solução, sempre existirão, embora em pequeno número, íons OH-. Nas soluções básicas também estarão presentes os íons H+. As concentrações desses íons jamais se anulam.
4. pH e grau de ionização
Considere um ácido fraco genérico HkA. Ao dissolver M mols desse ácido em água, de maneira que forme 1 litro de soluçai, a concentração em mol/L e a normalidade serão:
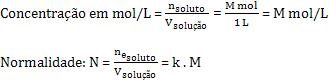
O grau de ionização do ácido é:
Logo, a quantidade em mols que ioniza = α . M.
Considere o equilíbrio da ionização:
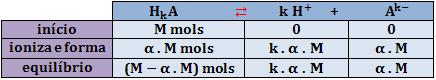
A concentração hidrogeniônica no equilíbrio final é:
Portanto: [H+] = α . N ou [H+] = α . k . M
Sendo que k é o número de hidrogênios ionizáveis.
pH
Sörensen definiu pH como sendo o logaritmo (decimal) do inverso da concentração hidrogeniônica:
pH = log 1/[H+]
Ou ainda, como o cologarítmo da concentração hidrogeniônica:
pH = colog [H+]
Ou seja:
pH = log 1/[H+] → pH = log 1 – log [H+]
Como log 1 = 0:
pH = -log[H+] ou pH = colog [H+]que é igual ao inverso do log.
Vejamos a variação do pH em função das concentrações de H+ e OH-, a 25 °C:
Meio neutro: pH = 7
Meio ácido: pH < 7
Meio básico: pH > 7
pOH
Por analogia, define-se pOH como sendo o logaritmo (decimal) do inverso da concentração hidroxiliônica:
pOH = log 1/[OH-]
Ou ainda, como sendo o cologaritmo da concentração de OH-:
pOH = colog [OH-]
Assim:
pOH = log 1/[OH-] → pOH = log 1 – log [OH-]
Como log 1 = 0:
pOH = -log[OH-] ou pOH = colog [OH-]
Vejamos a variação do pOH em função das concentrações de OH- e H+:
Meio neutro: pOH = 7
Meio ácido: pOH > 7
Meio básico: pOH < 7
Relação entre pH e pOH:
pH + pOH = 14 (25 °C)
Observação:
Os conceitos de pH e pOH indicam que em qualquer solução coexistem H+ e OH-. Por mais ácida que seja a solução, sempre existirão, embora em pequeno número, íons OH-. Nas soluções básicas também estarão presentes os íons H+. As concentrações desses íons jamais se anulam.
Sörensen definiu pH como sendo o logaritmo (decimal) do inverso da concentração hidrogeniônica:
pH = log 1/[H+]
Ou ainda, como o cologarítmo da concentração hidrogeniônica:
pH = colog [H+]
Ou seja:
pH = log 1/[H+] → pH = log 1 – log [H+]
Como log 1 = 0:
pH = -log[H+] ou pH = colog [H+]
que é igual ao inverso do log.
Vejamos a variação do pH em função das concentrações de H+ e OH-, a 25 °C:
Meio neutro: pH = 7
Meio ácido: pH < 7
Meio básico: pH > 7
pOH
Por analogia, define-se pOH como sendo o logaritmo (decimal) do inverso da concentração hidroxiliônica:
pOH = log 1/[OH-]
Ou ainda, como sendo o cologaritmo da concentração de OH-:
pOH = colog [OH-]
Assim:
pOH = log 1/[OH-] → pOH = log 1 – log [OH-]
Como log 1 = 0:
pOH = -log[OH-] ou pOH = colog [OH-]
Vejamos a variação do pOH em função das concentrações de OH- e H+:
Meio neutro: pOH = 7
Meio ácido: pOH > 7
Meio básico: pOH < 7
Relação entre pH e pOH:
pH + pOH = 14 (25 °C)
Observação:
Os conceitos de pH e pOH indicam que em qualquer solução coexistem H+ e OH-. Por mais ácida que seja a solução, sempre existirão, embora em pequeno número, íons OH-. Nas soluções básicas também estarão presentes os íons H+. As concentrações desses íons jamais se anulam.
5. pH e constante de ionização (ki) Tendo conhecimento da concentração da solução e a constante de ionização, podemos calcular o pH. Com os valores da concentração e do pH, calcula-se o valor de Ki.
Exemplo:
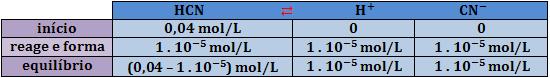
Vamos calcular a constante de ionização do ácido cianídrico, tendo conhecimento de que o pH de uma solução 0,04M de HCN é 5.
Nesse caso, temos:
pH = 5 ⇒ [H+] = 1 . 10-5 mol/L
Analisemos atentamente o equilíbrio:
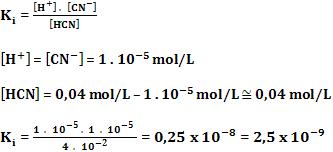
Exemplo:
Vamos calcular a constante de ionização do ácido cianídrico, tendo conhecimento de que o pH de uma solução 0,04M de HCN é 5.
Nesse caso, temos:
pH = 5 ⇒ [H+] = 1 . 10-5 mol/L
Analisemos atentamente o equilíbrio:

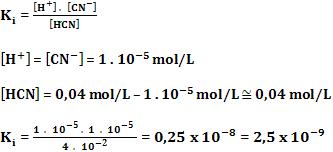
6. Calculo do pH em temperatura diferente de 25ºC
A temperatura provoca o aumento do produto iônico da água.
Numa temperatura de 25°C, temos:
Kw = [H+] . [OH–] = 1,0 x 10-14 (mol/L)2
Aumentando a temperatura para 45°C, temos:
Kw = [H+] . [OH–] = 4,0 x 10-14 (mol/L)2
Para qualquer temperatura é válido o seguinte:
meio neutro: [H+] = [OH–]
meio ácido: [H+] > [OH–]
meio básico: [OH–] > [H+]
Portanto, a 45°C, um meio com pH = 7 é básico.
A temperatura provoca o aumento do produto iônico da água.
Numa temperatura de 25°C, temos:
Kw = [H+] . [OH–] = 1,0 x 10-14 (mol/L)2
Aumentando a temperatura para 45°C, temos:
Kw = [H+] . [OH–] = 4,0 x 10-14 (mol/L)2
Para qualquer temperatura é válido o seguinte:
meio neutro: [H+] = [OH–]
meio ácido: [H+] > [OH–]
meio básico: [OH–] > [H+]
25°C | 45°C |
| Meio neutro [H+] = [OH–] = 1,0 x 10-7 mol/L pH = 7 pOH = 7 | Meio neutro [H+] = [OH–] = 2,0 x 10-7 mol/L pH = - log 2,0 x 10-7 = 6,7 pOH = - log 2,0 x 10-7 = 6,7 |
| Meio ácido [H+] > 1,0 x 10-7 mol/L pH < 7 pOH > 7 | Meio ácido [H+] > 2,0 x 10-7 mol/L pH < 6,7 pOH > 6,7 |
| Meio básico [OH–] > 1,0 x 10-7 mol/L pOH < 7 pH > 7 | Meio básico [OH–] > 2,0 x 10-7 mol/L pOH < 6,7 pH > 6,7 |
Portanto, a 45°C, um meio com pH = 7 é básico.
8. Soluções – tampão
Solução-tampão é aquela que não sofre variação apreciáveis de pH ao adicionarmos pequenas quantidades de ácido forte ou base forte.
“As soluções-tampão, em geral, são soluções formadas por ácido fraco e um sal do mesmo ácido, ou uma base fraca e um sal da mesma base.”
Exemplos:
1) H3C — COOH + H3C — COONa
2) H2CO3 + NaHCO3
3) NH4OH + NH4Cl
Considere uma solução-tampão formada por H3C — COOH e H3C — COONa.
Se adicionarmos a esta solução uma pequena quantidade de NaOH, tal solução praticamente desaparece, pois entra em reação com o ácido do tampão e o pH sofre apenas um pequeno aumento.
NaOH + H3C — COOH → H3C — COONa + H2O
9. Formula de Henderson–Hasselbach
Considere uma solução-tampão formada por um ácido fraco HA e um sal B+A–. Visto que o ácido é fraco, sua ionização pode ser representada por:
A dissociação do sal seria:
Ao colocar o Ki para o ácido, teremos:
Tomando o (-log) do 1º e 2º membros:
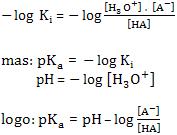
Como o ácido é fraco e o sal é muito dissociado, quase todo o A– vem do sal, e assim quase toda a concentração de A– é igual à concentração do sal B+A–.
Temos:
OU
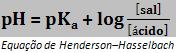
Se a solução-tampão for formada por uma base fraca e um sal dessa base, a equação será:

Nenhum comentário:
Postar um comentário