HIDRÓLISE DE SAIS
1. Introdução
Quando o sal reage com a água produzindo ácido e base, chamamos tal reação de hidrólise. É a reação inversa da neutralização.

“Os sais derivados de ácidos fortes e bases fortes (conceito de Arrhenius) não sofrem hidrólise”
Portanto, vamos estudar neste capítulo os três tipos de sais que sofrem ionização: sal de ácido fraco e base forte, sal de ácido forte e base fraca, e sal de ácido fraco e base fraca.
Quando o sal reage com a água produzindo ácido e base, chamamos tal reação de hidrólise. É a reação inversa da neutralização.

“Os sais derivados de ácidos fortes e bases fortes (conceito de Arrhenius) não sofrem hidrólise”
Portanto, vamos estudar neste capítulo os três tipos de sais que sofrem ionização: sal de ácido fraco e base forte, sal de ácido forte e base fraca, e sal de ácido fraco e base fraca.
2. Sal de ácido fraco e base forte
Exemplos:
Acetato de sódio, Na+(H3C — COO)– — derivado do ácido acético, fraco: H3C — COOH, e do hidróxido de sódio, forte: NaOH.
Cianeto de potássio, K+CN– — derivado do ácido cianídrico, fraco: HCN, e do hidróxido de potássio, forte: KOH.
Tomemos como exemplo o acetato de sódio. Sua equação será escrita, classicamente, assim:

No entanto, atualmente esta equação não é escrita assim. O sal é composto iônico, e encontra-se dissociado em solução; o hidróxido de sódio (base forte) também apresenta-se dissociado; o ácido acético (ácido fraco) praticamente não está dissociado.
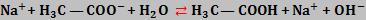
Na verdade, o que acontece é o seguinte:

O íon acetato é uma base forte (o ácido acético, ácido conjugado, é fraco), sendo capaz de receber próton da água.
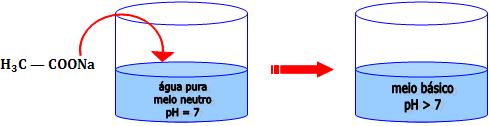
A água pura tem pH = 7. Se adicionarmos acetato de sódio na água, o meio ficará alcalino (ph maior que sete), em razão da conseqüente formação de íons OH– pela hidrólise dos íons acetato.
Exemplos:
Acetato de sódio, Na+(H3C — COO)– — derivado do ácido acético, fraco: H3C — COOH, e do hidróxido de sódio, forte: NaOH.
Cianeto de potássio, K+CN– — derivado do ácido cianídrico, fraco: HCN, e do hidróxido de potássio, forte: KOH.
Tomemos como exemplo o acetato de sódio. Sua equação será escrita, classicamente, assim:
No entanto, atualmente esta equação não é escrita assim. O sal é composto iônico, e encontra-se dissociado em solução; o hidróxido de sódio (base forte) também apresenta-se dissociado; o ácido acético (ácido fraco) praticamente não está dissociado.
Na verdade, o que acontece é o seguinte:
O íon acetato é uma base forte (o ácido acético, ácido conjugado, é fraco), sendo capaz de receber próton da água.
A água pura tem pH = 7. Se adicionarmos acetato de sódio na água, o meio ficará alcalino (ph maior que sete), em razão da conseqüente formação de íons OH– pela hidrólise dos íons acetato.

Considerando o equilíbrio:
A expressão da constante de equilíbrio pode ser escrita assim:
A concentração da água, [H2O] é praticamente constante. Podemos associá-la a K´ e definir uma nova constante de equilíbrio, Kh:
K´ . [H2O] = Kh
Kh é denominada constante de hidrólise do íon:
O valor de Kh depende da natureza do íon e da temperatura:
Outros dois equilíbrios ocorrem na solução:
a) ionização do ácido fraco
A constante de ionização do ácido é dada pela expressão:
b) auto-ionização da água
O produto iônico da água é dado por:
Os três equilíbrios ocorrem ao mesmo tempo, na mesma solução, de tal forma que o íon OH–, que faz parte da hidrólise, por exemplo, é o mesmo da auto-ionização da água.
Vamos multiplicar, na expressão do Kh, o numerador e o denominador pela concentração [H3O+]:
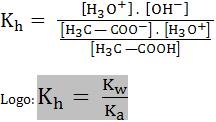
Desse modo, a constante de hidrólise para a reação de um ânion com a água é a relação entre o produto iônico da água e a constante de ionização do ácido fraco que se forma na reação.
4. Grau de hidrolise
Grau de hidrólise é a relação entre a quantidade em mols de sal hidrolisado e a quantidade em mols de sal dissolvido.
O valor do grau de hidrólise varia de 0 a 1. Em porcentagem, varia de 0% a 100%.
5. Cálculo do pH da solução
A partir da concentração do sal e o valor da constante de ionização do ácido, podemos calcular o pH do solução.
Exemplo:
Vamos calcular a constante de hidrólise, o grau de hidrólise e o pH de uma solução 1,0M de NaCN, tendo conhecimento de que a constante de ionização do ácido cianídrico é 4 x 10-10, a 25°C.
a) Constante de hidrólise
b) Grau de hidrólise
Vamos analisar o equilíbrio:
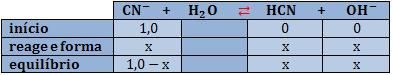
Visto que a constante de hidrólise é muito pequena, a quantidade em mols que hidrolisa (x) é suficientemente pequena, para que possamos fazer
Temos, então:
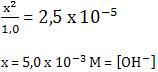
Em porcentagem: 5,0 x 10-1% = 0,5%
c) pH da solução
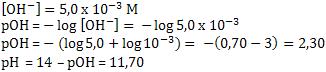
6. Sal de ácido forte e base fraca
Exemplo:
Classicamente, a equação seria escrita da seguinte forma:
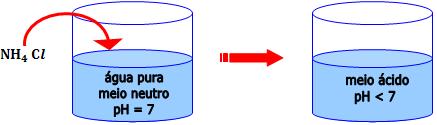
O íon cloreto (Cl–) não se hidrolisa, porque é uma base extremamente fraca (HCl ácido muito forte). O íon amônio,
Se adicionarmos NH4Cl à água, a solução ficará ácida (haverá formação de H3O+, em razão da hidrólise), ou seja, o pH será menor que 7.
7. Constante de hidrolise
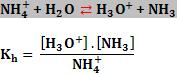
Outros dois equilíbrios ocorrem na solução:
a) ionização da base fraca

A constante de ionização da base é dada por:
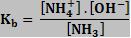
b) auto-ionização da água

O produto iônico da água é dado por:
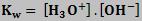
Vamos multiplicar, na expressão do Kh, o numerador e o denominador pela concentração [OH–]:
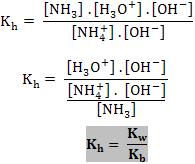
A constante de hidrólise para a reação de um cátion com água é a relação entre Kw e a constante de ionização da base fraca que se forma na reação.
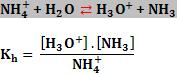
Outros dois equilíbrios ocorrem na solução:
a) ionização da base fraca
A constante de ionização da base é dada por:
b) auto-ionização da água
O produto iônico da água é dado por:
Vamos multiplicar, na expressão do Kh, o numerador e o denominador pela concentração [OH–]:
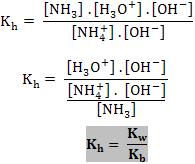
A constante de hidrólise para a reação de um cátion com água é a relação entre Kw e a constante de ionização da base fraca que se forma na reação.
5. Cálculo do pH da solução
A partir da concentração do sal e o valor da constante de ionização do ácido, podemos calcular o pH do solução.
Exemplo:
Vamos calcular a constante de hidrólise, o grau de hidrólise e o pH de uma solução 1,0M de NaCN, tendo conhecimento de que a constante de ionização do ácido cianídrico é 4 x 10-10, a 25°C.
a) Constante de hidrólise
b) Grau de hidrólise
Vamos analisar o equilíbrio:

Visto que a constante de hidrólise é muito pequena, a quantidade em mols que hidrolisa (x) é suficientemente pequena, para que possamos fazer
Temos, então:
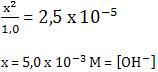
Em porcentagem: 5,0 x 10-1% = 0,5%
c) pH da solução
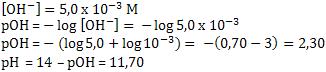
9. Sal de ácido fraco e base fraca
Exemplos:
Classicamente, se considerarmos o acetato de amônio, teríamos:
Na realidade, os dois íons sofrem hidrólise:
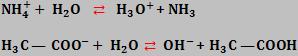
“O pH da solução depende das constantes de ionização do ácido fraco e da base fraca formados na reação.”
7. Constante de hidrolise
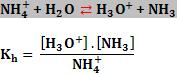
Outros dois equilíbrios ocorrem na solução:
a) ionização da base fraca
A constante de ionização da base é dada por:
b) auto-ionização da água
O produto iônico da água é dado por:
Vamos multiplicar, na expressão do Kh, o numerador e o denominador pela concentração [OH–]:
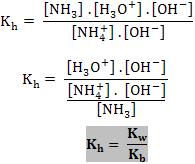
A constante de hidrólise para a reação de um cátion com água é a relação entre Kw e a constante de ionização da base fraca que se forma na reação.
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário