A pressão de vapor depende somente da natureza do liquido e da temperatura
A pressão de vapor depende exclusivamente da natureza do líquido e da sua temperatura, não depende da quantidade de líquido nem do espaço ocupado pelo vapor.
Quando as forças intermoleculares são muito intensas, a vaporização é pouco provável e a pressão do vapor é menor. Porém, se as moléculas não estiverem fortemente presas ao líquido, a vaporização ocorre com facilidade e a pressão de vapor é maior.
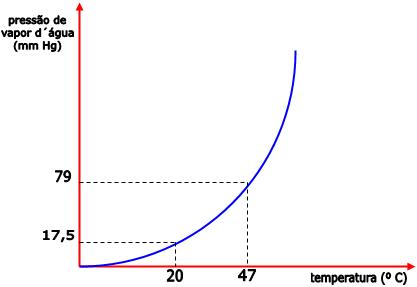
Podemos dizer que, sob uma temperatura de 20°C, a pressão máxima de vapor de água é 17,5mm de Hg e a pressão máxima de vapor do álcool etílico (etanol) é 44mm Hg. Portanto, o álcool é mais volátil que a água.
Conforme a temperatura aumenta, ocorre também o aumento na pressão de vapor do líquido. Portanto, sob uma temperatura de 27°C, a pressão máxima de vapor da água é de 26mm de Hg. E sob a temperatura de 47°C a pressão máxima de vapor da água é de 79 mm Hg. O diagrama abaixo representa essa relação entre pressão de vapor e temperatura.
Cálculo do número de partículas dispersas
Cálculo do numero de partículas dispersas
Considere dois casos:
1. Soluções moleculares
As moléculas que formam o soluto são dissolvidas naturalmente no solvente; portanto, as partículas dispersas são moléculas do soluto, e o número de partículas dispersas é equivalente ao número de moléculas dissolvidas.
Npd = Nd
Npd = Número de partículas dispersas
Nd = Número total de moléculas dissolvidas
Exemplo:
Vamos determinar o número de partículas dispersas, ao dissolver 171g de sacarose em 1 litro de água.
Massa molar da sacarose: 342 g/mol
342 é a massa de 6,02 x 1023 moléculas de sacarose.
171g é a massa de 6,02 x 1023 moléculas de sacarose.
2. Soluções iônicas
O soluto, quando ainda não é constituído por íons, sofre uma ionização quando é dissolvido ocorrendo o aparecimento de íons. Portanto, o número de partículas dispersas é equivalente ao número de moléculas não-ionizadas, somado ao número de íons presentes.
Npd = quantidade de moléculas não-ionizadas somadas à quantidade de íons.
Considerando α como o grau de ionização do soluto na solução, temos:
Onde:
Ni = número de moléculas que se ionizaram.
Exemplo:
Considere que 100 moléculas de HCl foram dissolvidas em água. Sendo que somente 90 moléculas se ionizam, formando 90 cátions H+ e 90 ânions Cl-. Restam 10 moléculas de HCl que não sofreram a ionização.
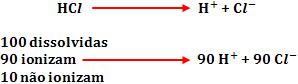
Logo, restou um total de 190 partículas dispersas:
10 moléculas HCl não ionizadas + 90 cátions H+ + 90 ânions Cl- = 190 partículas dispersas.
Conclusões de Van´t Hoff
Conclusões de Van’t Hoff
Van’t Hoff verificou uma relação de semelhança entre a pressão dos gases e a pressão osmótica das soluções diluídas. Baseado nas experiências de pressão osmótica do estudioso Pfeffer constatou-se uma semelhança com as leis dos gases de Boyle e de Charles:
“A pressão osmótica de uma solução é igual à pressão que o soluto exercia no estado gasoso, ocupando o mesmo volume da solução, na mesma temperatura.”
Portanto, podemos aplicar a equação dos gases perfeitos:

Equação da Pressão Osmótica
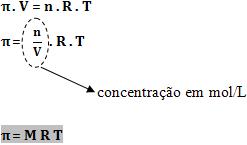
M = concentração em quantidade de matéria (mol/L)
R = constante dos gases perfeitos
T = temperatura absoluta
Para pressão em atmosfera, o valor de R será 0,082 atm . L . (mol . K)-1. E para pressão osmótica em milímetro de mercúrio, o valor de R será 62,3 mm Hg . L . (mol . K)-1.
Para soluções iônicas, devemos usar o fator de correção de Van’t Hoff:
i = α(q – 1) + 1
Como a pressão osmótica depende da concentração de partículas dispersas, é considerada uma pressão osmótica.
Chamamos de isotônicas as soluções com a mesma pressão osmótica. Quando as soluções osmóticas apresentam diferenças são denominadas anisotônica.
As soluções que apresentam intensa pressão osmótica são denominadas hipertônicas, e as soluções de pressão osmótica fraca são hipotônicas.
Tonometria ou Tonoscopia
A tonometria estuda o abaixamento da pressão máxima de vapor de um solvente por adição de um soluto não-volátil.
Considere um cilindro ligado a um manômetro, contendo no seu interior um líquido puro (solvente). Considere outro cilindro, também ligado a um manômetro, só que contendo no seu interior um solvente misturado com um soluto X não-volátil (solução).
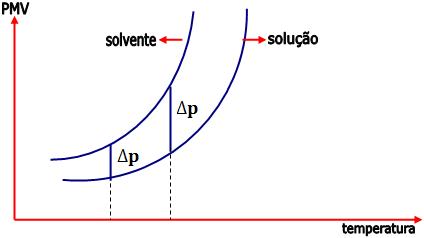
A partir desta experiência, vamos notar que a pressão de vapor da solução é menor que a do solvente puro, isto ocorre, pois as partículas do soluto X consomem a energia cinética das moléculas do solvente, não permitindo que parte destas receba o estado de vapor.
As partículas dispersas formam uma barreira, dificultando a movimentação das moléculas do solvente do líquido para a fase gasosa.
∆p = p – p’
Onde:
p: pressão máxima de vapor do solvente puro.
p’: pressão máxima de vapor do solvente na solução.
∆p: abaixamento da pressão máxima de vapor
O abaixamento da pressão máxima de vapor (∆p) depende da temperatura.
O quociente entre o abaixamento da pressão máxima de vapor (∆p) e a pressão máxima de vapor do solvente puro (p) é chamado de abaixamento relativo da pressão máxima de vapor.
O abaixamento relativo não depende da temperatura, pois a sua variação promove a variação de ∆p e p, de mesma magnitude, não influenciando no quociente, desde que o soluto seja não-volátil.
Lei de Raoult: “O abaixamento relativo da pressão máxima de vapor de um líquido, produzido pela dissolução de uma substância não-volátil (dando solução molecular), é diretamente proporcional à concentração da solução em mol por quilograma de solvente (Mm).”
Kt = constante tonométrica (característica do solvente)
Mm = concentração da solução em mol/kg.
n = quantidade de matéria do soluto.
A lei de Raoult só pode ser aplicada em soluções diluídas e moleculares. Para as soluções iônicas, como o abaixamento relativo da pressão máxima de vapor é uma propriedade coligativa , deve ser aplicado o Fator de Correção de Van’t Hoff (i).
Criometria ou crioscopia
Criometria ou Crioscopia
Ao dissolver um soluto numa massa líquida, ocorre um abaixamento do ponto de congelamento.
Lei de Raoult: O abaixamento do ponto de congelação de um líquido pela dissolução de uma substância qualquer (dando solução molecular) é diretamente proporcional à concentração da solução (em mol/kg de solvente).
∆tc = abaixamento da temperatura de congelação.
Kc: constante criométrica (característica do solvente).
Em soluções iônicas:
Cálculo constante criométrica
Onde:
R: constante dos gases perfeitos = 2 cal/mol k
Tc0: temperatura absoluta de congelação do solvente (K)
Lf: calor latente de fusão do solvente (cal/mol)
Ebuliometria ou ebulioscopia
Ebuliometria ou ebulioscopia
Ebuliometria é o estudo do aumento da temperatura de ebulição de um solvente quando nele se dissolve uma substância não-volátil.
A variação da temperatura de ebulição ocorre com a variação da pressão externa.
Ao adicionar um soluto não-volátil a um solvente líquido, também ocorre a elevação da temperatura de ebulição. O soluto não-volátil dificulta a evaporação das moléculas, consumindo a sua energia cinética.
Lei de Raoult: A elevação do ponto de ebulição de um líquido, pela dissolução de uma substância não-volátil (dando solução molecular), é diretamente proporcional à concentração da solução em mol por quilograma de solvente.
∆te = Ke . Mm
Onde:
∆te: elevação da temperatura de ebulição
Ke: constante ebuliométrica (característica do solvente)
Para solução eletrolítica:
∆te = Ke . Mm . i
Cálculo da constante ebuliométrica
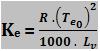
Te0 = temperatura absoluta de ebulição do solvente (K)
Lv = calor latente de vaporização do solvente (cal/g)
R = constante dos gases perfeitos = 2 cal/mol . K
Explicação do fenômeno da osmose
Explicação do fenômeno da osmose
Considere uma campânula completamente fechada, contendo no seu interior um recipiente com água pura e outro com solução aquosa de glicose.
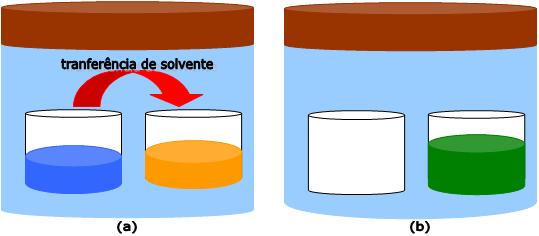
A água pura possui uma pressão de vapor maior do que solução, isto significa que a água pura sofre evaporação com mais facilidade. Conseqüentemente, há uma transferência de água do recipiente da esquerda para o da direita.
Na osmose ocorre o mesmo, o solvente atravessa a membrana semipermeável na forma de vapor, ocorrendo uma destilação do mesmo, evaporando de um lado e condensando do outro.
Fator de correção de Van´t Hoff
Fator de correção de Van´t Hoff
Observe que o número de partículas dispersas é equivalente ao número de moléculas dissolvidas multiplicado pelo fator de correção de Van´t Hoff representado por i.
Npd = Nd . i
Usando o exemplo anterior, temos:
190 = 100 . 1,9
Demonstra-se que:
i = 1 + α (q – 1)
Onde:
q = número de íons formado na ionização de 1 molécula.
Ainda no mesmo exemplo:
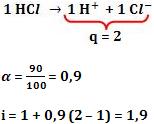
Observação:
Se α = 0, ou seja, o soluto não sofre ionização, temos:
i = 1 + 0 (q – 1) = 1
Se α = 1, ou seja, todas as moléculas ionizam, temos:
i = 1 + 1 (q – 1) = q
Osmose Reserva
Osmose Reversa
Osmose reserva é um processo que consiste na aplicação de uma pressão elevada para deixar a água fluir de uma concentração mais concentrada para uma solução menos concentrada, através da membrana semipermeável.
A osmose reserva é usada para a dessalinização das águas dos oceanos. A pressão osmótica da água dos oceanos é da ordem de 30 atm. Ao aplicar uma pressão maior que 30 atm à solução salina, o fluxo osmótico será revertido, obtendo a água potável.
Ponto Triplo
Ponto Triplo
1) Equilíbrio líquido – vapor
Em cada temperatura há uma determinada pressão exercida pelo vapor em equilíbrio com o seu líquido.
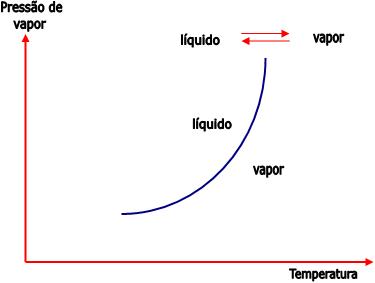
2) Equilíbrio sólido – líquido
Um sólido pode estar em equilíbrio com o seu líquido, sob determinada pressão e temperatura.
Para que ocorra esse equilíbrio é necessária uma determinada temperatura para cada valor da pressão.
Seja o equilíbrio:
Sabemos que a densidade da água sólida é menor do que da água líquida. Portanto, o aumento da pressão transfere o equilíbrio para a direita, e isto quer dizer que a fusão do sólido torna-se mais fácil. Logo, para manter o equilíbrio, é necessário abaixar a temperatura quando a pressão aumentar.
Veja no gráfico abaixo, a curva que representa o equilíbrio da água:
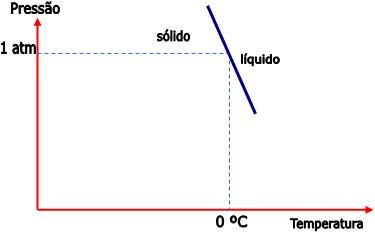
3) Equilíbrio sólido – vapor
Chamamos de sublimação a passagem do estado sólido para o estado gasoso. O processo inverso recebe o nome de ressublimação ou deposição.
Dependendo das condições de pressão e temperatura, pode ocorrer o seguinte equilíbrio:
O aumento da pressão transfere o equilíbrio para a esquerda. Para manter o equilíbrio é necessária uma temperatura maior.
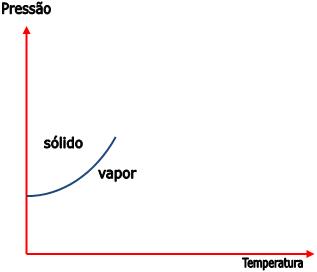
4) Ponto triplo – diagrama de fases
O diagrama de fases é uma representação gráfica das condições de pressão e temperatura de uma substância nos estados líquido, sólido e gasoso.
Veja abaixo o diagrama de fases para a água.
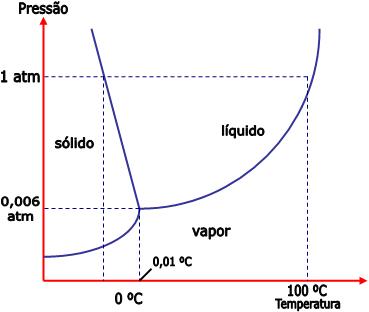
O gráfico está dividido em três áreas, cada uma delas representa uma fase pura. A linha cheia mostra as condições sob as quais duas fases podem existir em equilíbrio. O ponto triplo é onde as três curvas se encontram, é o ponto de equilíbrio entre as três fases.
O ponto triplo da água ocorre sob a temperatura 0,01°C e 0,006 atm. Apenas nessas condições, a água pode existir nas três fases em equilíbrio.
Pressão de vapor e ponto de ebulição
Pressão de vapor e ponto de ebulição
Um líquido entra em ebulição quando a pressão de vapor do líquido torna-se igual a pressão existente sobre a superfície do líquido.
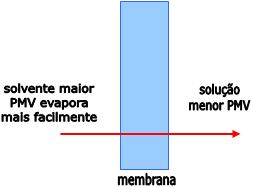
Quanto maior for a pressão de vapor nas condições ambientes, o líquido ferverá mais facilmente, isto significa que, quanto menor for o ponto de ebulição, mais volátil será o líquido.
Desse modo, sob uma temperatura de 20°C, a pressão máxima de vapor de água é 17,5mm de Hg e a pressão máxima de vapor do álcool é 44mm de Hg.
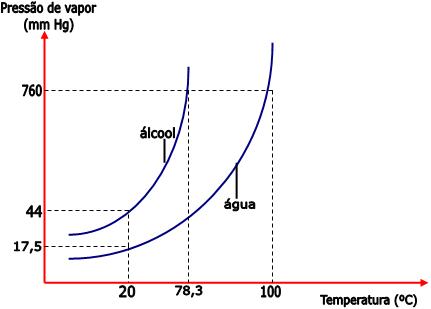
Observe no gráfico que, ao nível do mar (760 mmHg), o álcool etílico ferve a 78,3°C, e a água ferve a 100°C. Portanto, conforme a temperatura aumenta, a pressão máxima de vapor também aumenta. O álcool etílico entre em ebulição sob a temperatura de 78,3°C, pois nesta temperatura a sua pressão máxima de vapor se iguala à pressão atmosférica (760 mmHg à nível do mar). Já a pressão máxima de vapor da água se iguala a 760mm Hg sob a temperatura de 100°C.
Pressão máxima de vapor
Imagine um cilindro fechado contendo um líquido, com um espaço vazio acima da altura do líquido, e um manômetro. Com o nível de mercúrio dos dois ramos na mesma altura (figura a).
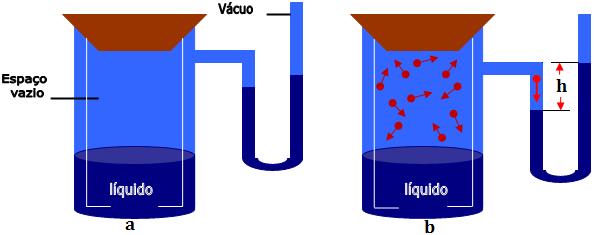
Primeiramente, as moléculas do líquido se deslocam para o espaço vazio do cilindro, formando a fase gasosa. A pressão exercida pelo vapor do líquido é medida pelo manômetro. Notamos que o nível do mercúrio sobe até certo ponto onde estaciona (figura b). A pressão exercida pelo vapor do líquido é medida pelo desnível h ente os dois níveis de mercúrio.
A pressão máxima de vapor é definida como a pressão exercida pelo vapor em equilíbrio.
Até que a velocidade de vaporização atinja o equilíbrio, ela é maior que a velocidade de condensação. Conforme a quantidade de vapor aumenta, a pressão do vapor também aumenta. A partir do momento em que o equilíbrio é alcançado, a concentração de moléculas na fase de vapor torna-se constante e a pressão não aumenta mais, ou seja, o seu valor máximo é atingido.
Como a superfície do líquido e a temperatura não se alteram, a velocidade de vaporização é constante.
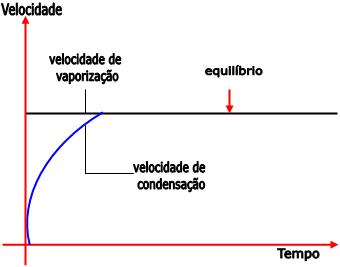
A velocidade de condensação torna-se igual à velocidade de vaporização no equilíbrio, ou seja, o número de moléculas que abandonam o líquido se iguala ao número de moléculas que voltam para o líquido.
A pressão máxima do vapor também pode ser chamada de pressão de vapor ou pressão de vapor de equilíbrio. Tal pressão é aquela que é exercida pelo vapor em equilíbrio com o seu líquido.
Quando o vapor está em equilíbrio com o seu líquido, ele é denominado vapor saturante.
Pressão osmótica das soluções
Chamamos de osmose a passagem de uma solução através de uma membrana semipermeável.
Tipos de membranas
Permeáveis: são membranas que possibilitam a passagem do solvente e do soluto.
Semipermeáveis: são membranas que possibilitam apenas a passagem do solvente, impedindo a passagem de parte de seus componentes.
Impermeáveis: são membranas que impedem a passagem do soluto e do solvente.

Nenhum comentário:
Postar um comentário