1 – Introdução
Reações de adição seguem um esquema geral, vejamos:
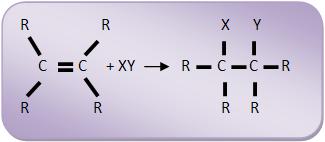
Estas reações ocorrem, com a alcadienos, alcenos, alcinos, aldeídos, ciclanos, ciclenos e cetonas.
2 – Adição em alcenos (alquenos)Reações de adição seguem um esquema geral, vejamos:

Estas reações ocorrem, com a alcadienos, alcenos, alcinos, aldeídos, ciclanos, ciclenos e cetonas.
Os alcenos (olefinas) possuem uma ligação pi que se desliga com maior facilidade do que a ligação sigma, com isso os alcenos se tornam mais reativos que os alcanos.
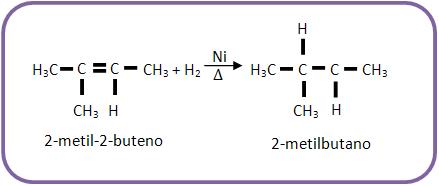
3 – Hidrogenação catalítica (Sabatier-Senderens)
0
A hidrogenação catalítica é uma reação com H2, na presença de Ni como catalisador.
Vejamos:
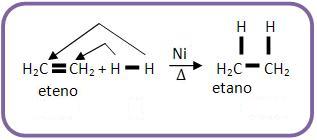
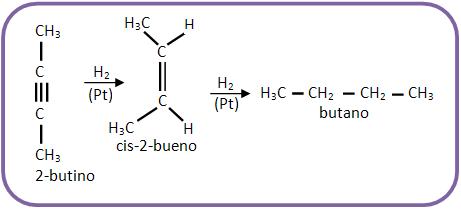
Nesta adição o ataque ocorre ao mesmo tempo e do mesmo lado (cis), como por exemplo: o que ocorre com a hidrogenação do 2-butino.
Vejamos:
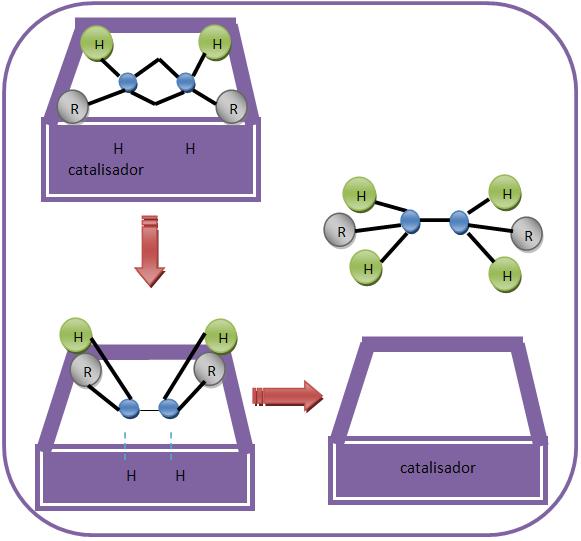
Mecanismo
O catalisador aparece como um suporte para que os reagentes se encontrem. Suponhamos que em sua superfície do catalisador aconteça uma quebra da ligação pi do alceno e da ligação hidrogênio-hidrogênio. Logo em seguida, os átomos de hidrogênio são levados para o alceno.
4 – Halogenação (X2)
Os alcenos adicionam halogênio, para formar dialetos vicinais, que são aqueles que apresentam dois átomos de halogênio em carbonos vizinhos.
Vejamos:
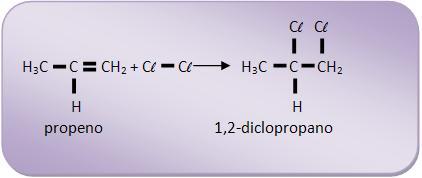
5- Reação com HX
Os haletos de alquila são formados através da adição de halogenetos (HX) de hidrogênio feita pelos alcenos.
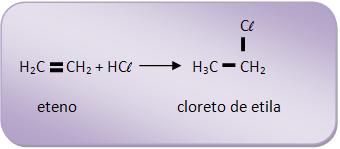
A) Regra de Markovnikov:
“Nas reações de adição, a porção positiva a adicionar (geralmente H) dirige-se par o carbono mais hidrogenado da insaturação.”
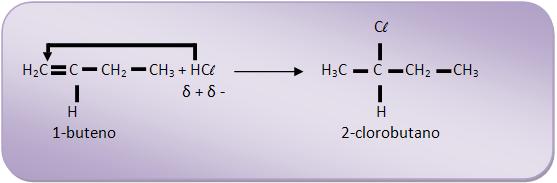
B) Regra de Kharasch:
“Na presença de peróxido (O2)2-, ocorre inversão da regra de Markovnikov”.
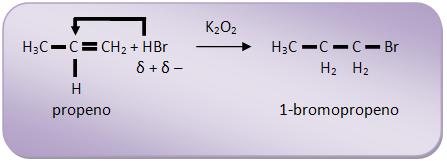
7 – Mecanismo da adição em alcenos
Com a insaturação nos alcenos é possível a união da molécula a outros átomos (reação de adição), deixando a molécula de um alqueno bem mais reativa que a de um alcano, como exemplo: o gás etileno que acrescenta cloro (à temperatura ambiente, sem necessidade de luz) resultando no líquido dicloroetano. Por se transformarem em hidrocarbonetos gasosos em di-haletos líquidos, os alquenos foram denominados olefinas, que são formadoras de óleos.
A adição eletrofílica é um tipo de adição feita nos alquenos, fazendo com que os hidrocarbonetos etilênicos funcionem como base de Lewis. Já todos os receptores de elétrons são denominados agentes eletrofílico, portando-se como ácido de Lewis.
Os grupos que fornecem agente eletrofílico são:
Cl2, Br2, I2, HI, HBr, HCl , H2SO4, HOCl
Considerando o grupo AB, podemos observar que a molécula AB se decompõe, formando o seguinte par d íons:
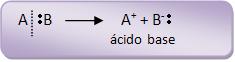
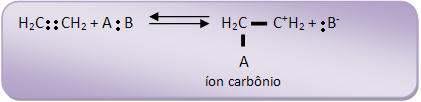
Na primeira fase ocorre o ataque dos átomos de carbono insaturado pelo íon positivo A+. Cria-se uma espécie intermediária (íon carbônio) junto com uma carga positiva no outro átomo de carbono.
Vejamos:
Na segunda fase, o íon carbônio combina-se com o íon B-.
Vejamos:
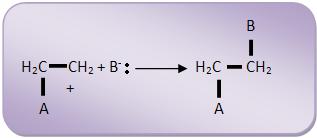
A velocidade é controlada pela primeira fase.
A) Cloração do eteno
1° fase

2° fase
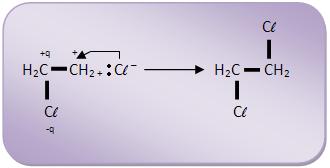
A adição é trans, onde os átomos de cloro chegam mais perto da molécula por lados opostos e o átomo de cloro do íon carbônio é considerado um pólo negativo que repele o íon Cl -, que ataca o íon carbônio pelo outro lado. Não pode ser comprovado tal experimento, pelo fato da possibilidade de uma livre rotação em volta da ligação simples, já na adição em compostos cíclicos a rotação irá se restringir através do ciclo, onde o produto inicial da adição é o trans.
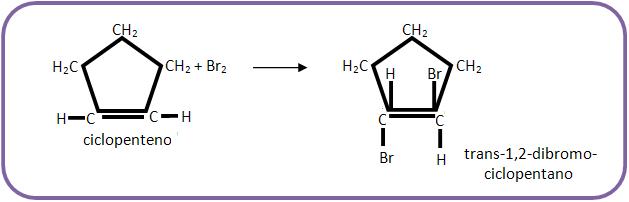
B) Adição de haletos de hidrogênio (HX)
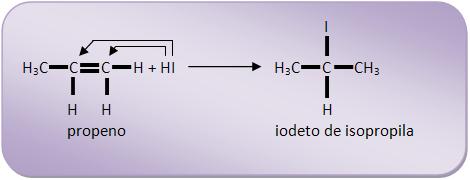
B.1) Regra de Markovnikov
“Nas reações de adição, o elemento eletropositivo (geralmente o hidrogênio) tem a propriedade de fixar-se no carbono mais hidrogenado”.
B.2) Mecanismo da Reação de Markovnikov
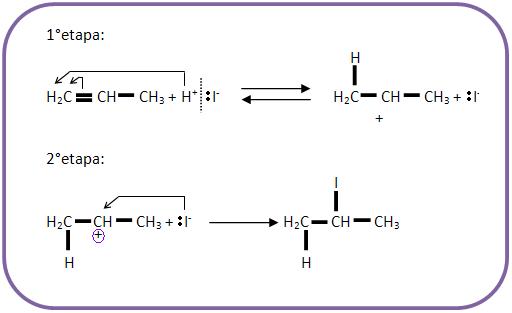
Portanto podemos concluir que quanto mais ácida a substância que atacar o alceno, maior será a reatividade. Com isso a ordem decrescente facilitará a adição.
Vejamos:
HI > HBr > HCl
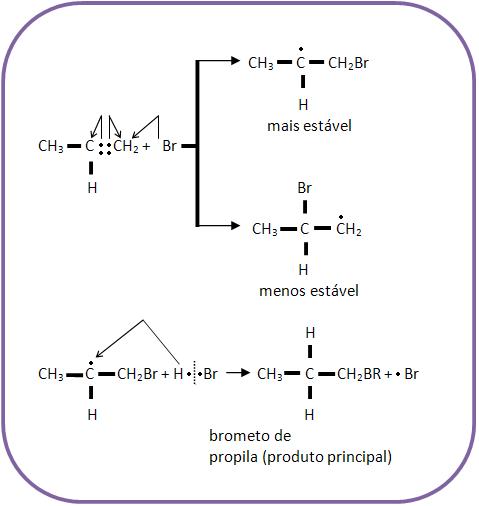
8 – Explicação da Regra de Markovnikov
Existem duas possibilidades na primeira fase, caso o hidrocarboneto etilênico seja assimétrico em relação à dupla. Observe o esquema abaixo:
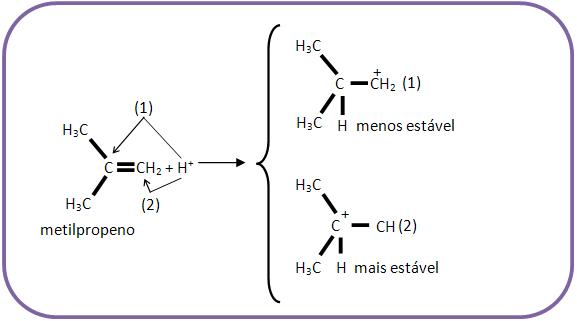
Como podemos observar os dois íons carbônicos são totalmente instáveis, porém o segundo é mais estável que o primeiro, pois é ele quem leva a carga positiva que está ligada a três grupos alcoílas que repelem elétrons, com a intenção de neutralizar a carga positiva, tendo assim o íon carbônico com maior estabilidade.
Nessa reação estabelece uma maior quantidade de iodeto de terciobutila e uma menor quantidade de iodeto de isobutila.
A ordem é diminuída com a estabilidade dos íons carbônio:
+
Terciário > secundário > primário > CH3
Vejamos a energia necessária para a formação dos íons carbônio abaixo:
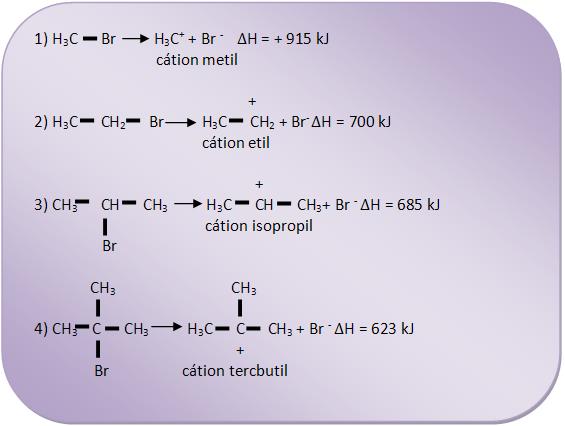
A partir daí podemos concluir que é necessário menos energia para estabelecer o cátion tercbutil do que o cátion isopropil. Pois o cátion tercbutil contém menos energia que o cátion isopropil, tornando-se mais estável.
9 – Explicação da reação de Kharasch
A adição de brometo de hidrogênio (HBr) aos alcenos pode não obedecer à Regra de Markovnikov, caso esteja na presença dos peróxidos.
A adição de Markovnikov é considerada eletrófila, já a adição de Kharasch ocorre através dos radicais livres.
Os peróxidos iniciam a reação de radical.
Vejamos a adição de HBr ao propeno.
- Na ausência de peróxido (Markovnikov):
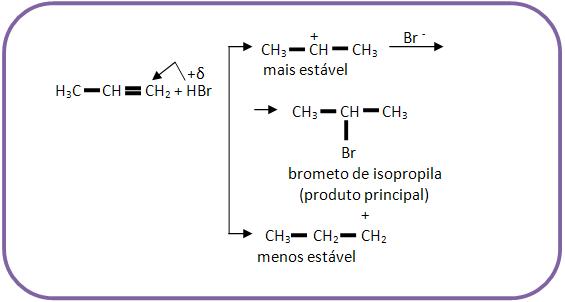
- Na presença de peróxido (Kharasch):
O peróxido de benzoíla é um peróxido orgânico muito utilizado.
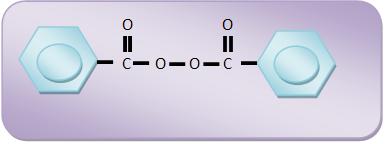
1) Início da cadeia
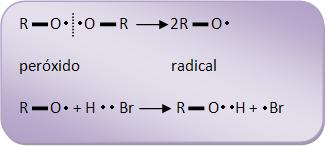
2) Propagação da cadeia
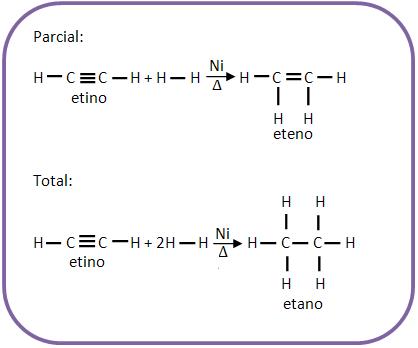
10 – Adição em alcinos (alquinos)
Todos os alcinos possuem duas ligações pi. Eles apresentam reações de adição dos alcenos, mesmo não apresentando reações de adição pelos alcenos
11. Hidrogenação catalítica
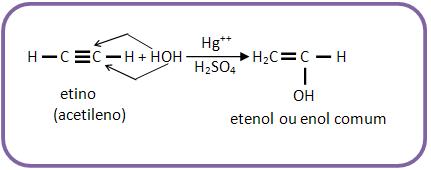
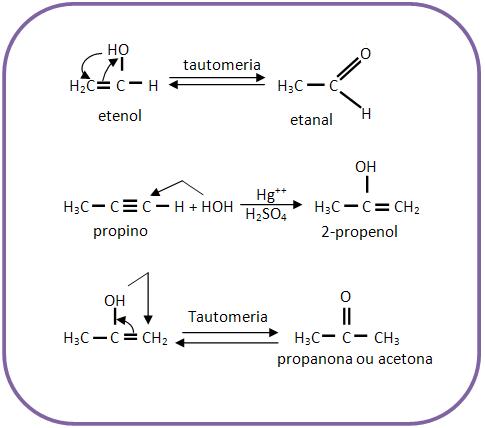
14- Reação com HOH: hidratação catalítica
Na presença de Hg++/H2SO4 os alcinos adicionam H2O, estabelecendo assim os enóis, através da tautomerização, podendo assim estabelecer os aldeídos ou cetonas.
15 – Reação com HCN
Os alcinos são diferentes dos alcenos, pois os alcinos adicionam o cianeto de hidrogênios se hidratando cataliticamente, já com os alcenos não acontece o mesmo. Este mecanismo ocorre por adição nucleofílica.
A adição de HCN a alquino é necleofílica, pois o ataque inicial a um carbono insaturado ocorre através de um íon negativo, que é atraído pelo núcleo positivo do carbono, estabelecendo assim um íon negativo (carbônio), junto com a carga negativa em átomo de carbono.
Vejamos:
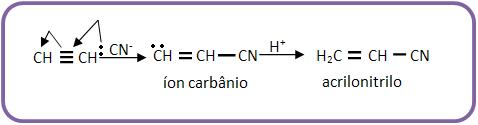
O acrilonitrilo é muito importante na fabricação de plásticos. Outra adição importante é a reação de acetileno junto com um ácido acético estabelecendo o acetato de vinila, muito usado na fabricação do polímero de polivinila.
Os alquenos não adicionam o cianeto de hidrogênio.
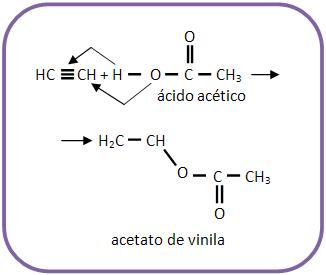
Nota:
O radical H2C = CH – recebe o nome de vinil ou vinila (etenil).
16 – Adição em alcadienos
Os alcadienos irão reagir com as mesmas substâncias que os alcenos reagem, a única diferença entre eles estará nas duas duplas ligações.
Vejamos:
Caso particular
Reação de adição-1,4 dos alcadienos conjugados
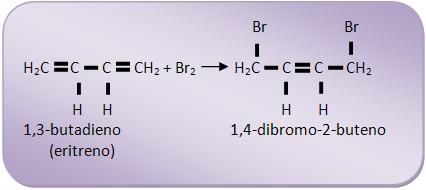
Forma simplificada:
1) Desaparecimento das duas duplas ligações primitivas.
2) Aparecimento de uma dupla ligação entre C2 e C3.
3) Adição dos átomos ou radicais aos átomos de carbono 1 e 4.
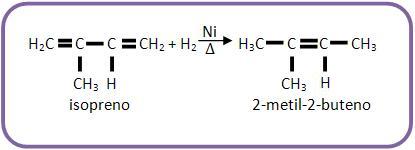
Se a reação continuar, deve-se proceder como no caso das reações dos alcenos, pois trata-se da reação de um alceno.
Vejamos a continuação da reação anterior:
Os alcadienos conjugados são usados na fabricação dos elastômeros (borrachas sintéticas). Já o isopreno é utilizado para formar a borracha natural.
17 – Ciclanos
Com exceção de alguns hidrocarbonetos alicíclicos, eles apresentam as mesmas reações que os hidrocarbonetos de cadeia aberta correspondente.
Vejamos os exemplos abaixo:
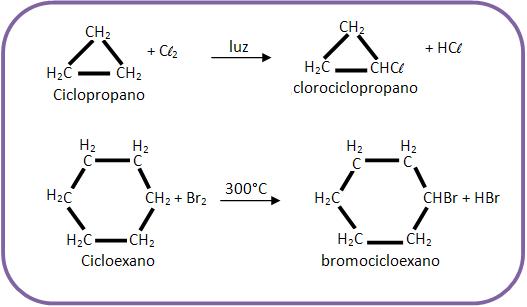
O ciclopropano e o ciclobutano apresentam reações de adição, onde a estrutura anelar é destruída.
O ciclobutano tem mais dificuldade para dar a reação de adição do que o ciclopropano. Já o ciclopropano tem mais dificuldade do que o alceno. Para entrar em processo de cloração, o ciclano precisa de um ácido de Lewis como catalisador para polarizar a molécula de cloro. O mesmo já não ocorre com os alcenos.
Com exceção de alguns hidrocarbonetos alicíclicos, eles apresentam as mesmas reações que os hidrocarbonetos de cadeia aberta correspondente.
Vejamos os exemplos abaixo:

O ciclopropano e o ciclobutano apresentam reações de adição, onde a estrutura anelar é destruída.
O ciclobutano tem mais dificuldade para dar a reação de adição do que o ciclopropano. Já o ciclopropano tem mais dificuldade do que o alceno. Para entrar em processo de cloração, o ciclano precisa de um ácido de Lewis como catalisador para polarizar a molécula de cloro. O mesmo já não ocorre com os alcenos.
18 – Hidrogenação dos ciclanos
Todos os ciclanos que possuem três átomos de carbono no ciclo, adicionam hidrogênio, quando há presença de níquel, a uma temperatura relativamente baixa (120°C). No caso dos ciclanos com quatro átomos de carbono no ciclo adicionam hidrogênio, quando há presença de níquel, a uma temperatura mais alta (200°C). Com os ciclanos com cinco átomos de carbono no ciclo adicionam hidrogênio, quando há presença de níquel, a uma temperatura ainda mais alta (300°C). Já os ciclanos que possuem seis átomos de carbono no ciclo, não adicionam hidrogênio.

Nenhum comentário:
Postar um comentário