Reações de substituição seguem o seguinte esquema geral:
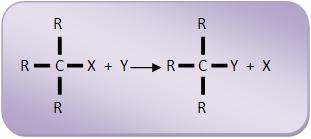
Essas reações ocorrem com alcanos, hidrocarbonetos aromáticos e derivados halogenados.
2 – Reações de substituição em alcanos
Os alcanos também são conhecidos como parafinas, pois são pouco reativos.
O hidrogênio que sofre substituição está ligado ao carbono terciário, e o mais dificilmente substituível está ligado ao carbono primário. Formando a ordem decrescente de facilidade de substituição do H:
C terciário > C secundário > C primário
Halogenação
Halogenação é a reação de substituição que ocorre na reação química quando um átomo de hidrogênio é substituído por um átomo de halogênio.
O iodo não reage diretamente com alcanos. O flúor misturado com alcanos apresenta reações violentíssimas.
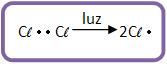
Nesta reação forma-se uma mistura de mono, dri, tri... poli derivados halogenados. A reação pode ficar mais acelerada com a luz solar e ultravioleta.
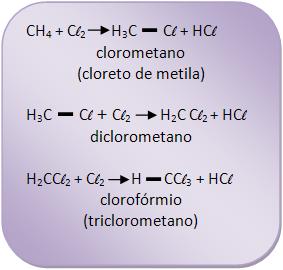
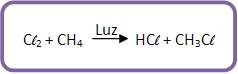
Quando há a mistura do metano com cloro, formam derivados clorados do metano. A reação pode ser explosiva com a presença de luz solar ou ultravioleta, vejamos:

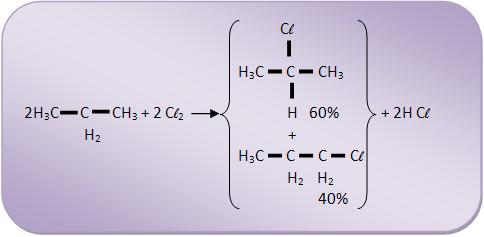
Quando alcanos têm três ou mais átomos de carbono sofrem esta reação, fornecendo uma mistura de compostos, aumentando intensidade da reação que acontece no carbono reativo.
Vejamos:
3 – Mecanismo da substituição em alcanos
É uma reação de substituição através do radical livre, uma reação de substituição que ocorre entre alcanos e halogênios.
Em experiências pode-se notar que:
a) Misturas de gás cloro e gás metano podem ser guardados por tempo indeterminado no escuro, pois não ocorrerá reação.
b) Uma exposição da mistura à luz dá inicio a uma reação de maneira violenta.
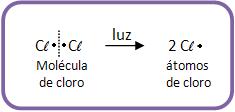
As absorções da luz pelas moléculas de cloro causam a decomposição das moléculas, formando átomos de cloro. Ocorrem então as reações em cadeia, onde muitas moléculas de cloreto de metila e cloreto de hidrogênio são formadas para cada molécula de cloreto que sofre fotólise (decomposição de moléculas orgânicas através do efeito da radiação eletromagnética).
1°) Início da cadeia:
2°) Propagação da cadeia:
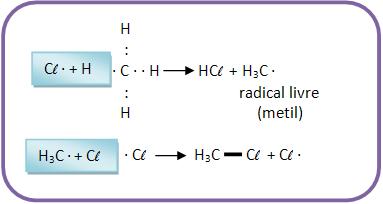
3°) Término da cadeia:
Reação total:
4 – Ordem de reatividade
Pelo fato do carbono ser mais eletronegativo que o hidrogênio, na ligação C-H ele apresenta uma carga parcial negativa. Por este motivo, o radical Áquila (R-), representado na figura abaixo, irá repelir elétrons. Vejamos:
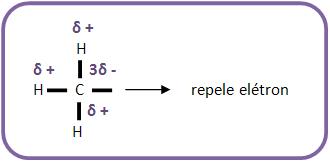
Caso o radical apresente átomos de carbono, contendo menos de oito elétrons na camada de valência, ele se tornará instável, pois quanto maior o número de radicais alquilas ligados a esse átomo de carbono, mais estável será o radical.
Observe na figura abaixo a ordem crescente de estabilidade:
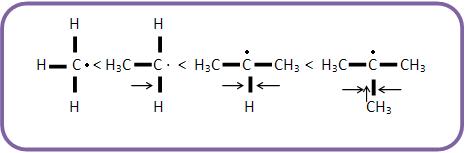
Quando há uma reação de substituição por radicais livres, o radical mais estável irá se formar em maior quantidade. Como exemplo, podemos citar a reação de propano com cloro, onde forma-se maior quantidade do radical isopropil do que propil.
Vejamos:

Com isso a quantidade de isopropila é maior que a quantidade de propila.
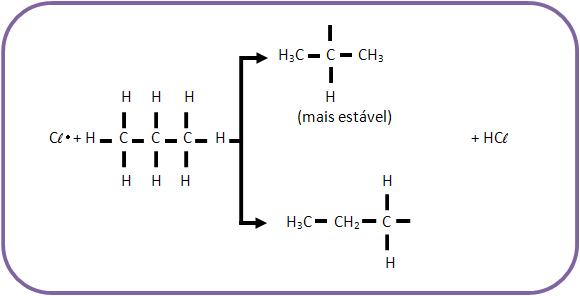
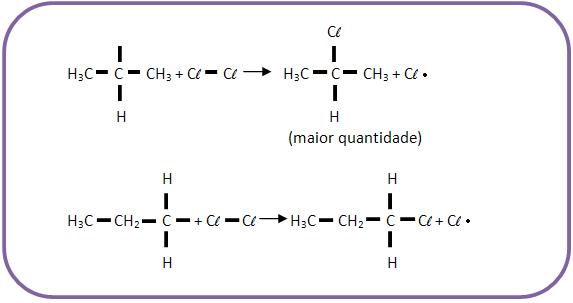
Portanto, a ordem crescente de facilidade de substituição, será:
C primário < C secundário < C terciário
5 – Reações de substituição nos compostos aromáticos
O benzeno e os compostos aromáticos são exemplos de reações de substituição.
A halogenação, a nitração e a sulfonação, são exemplos das principais reações de substituição, apresentadas pelos compostos aromáticos.
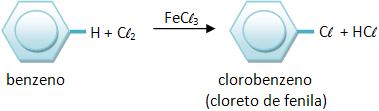
6 – Halogenação
Quando há FeX3 ou AlX3 ( X ≡ Cl ou Br), o cloro e o bromo age como catalisador, manifestando reações de substituições com o benzeno, onde o iodo não irá reagir com esses hidrocarbonetos.
Vejamos:
7 – Nitração
Os hidrocarbonetos aromáticos irão estabelecer nitroderivados aromáticos, quando reagirem com algumas misturas sulfonítricas (HNO3 concentrado e H2SO4 concentrado).
Para que haja a absorção de água durante o processo usa-se HNO3, o H2SO4.
Vejamos:
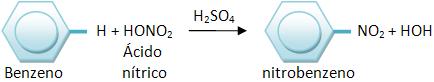
8 – Sulfonação
Os hidrocarbonetos aromáticos irão reagir com H2SO4 fumegante, através de um rápido aquecimento, pelas reações de substituição. Este processo apresenta formação de ácidos sulfônicos aromáticos.
Vejamos:
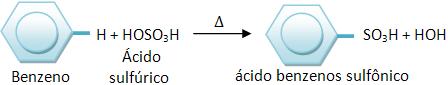
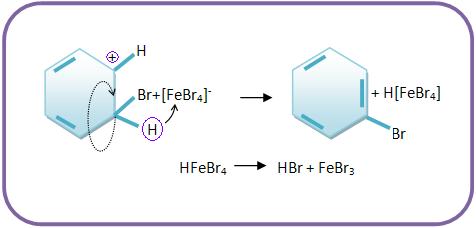
10 – Mecanismo da halogenação
O bromo só ataca o benzeno quando há a presença de luz e catalisadores, ou seja, quando não há presença de luz, o bromo não irá atacar o benzeno.
Porém quando se coloca o brometo férrico como catalisador, a reação se formará através do desprendimento de brometo de hidrogênio e com a formação de bromo-benzeno.
Etapas:
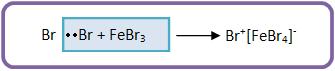
a) O brometo férrico (ácido de Lewis) combinado com o bromo forma um complexo iônico, junto com uma parte de forte caráter eletrofílico (o íon Br+).
Vejamos:
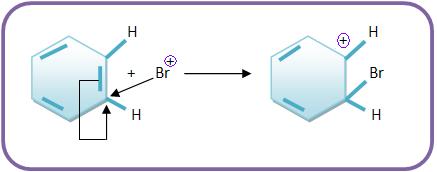
b) O íon Br+ para formar um íon carbônico, deve atacar o benzeno, apresentando com carga positiva um carbono trivalente.
Vejamos:
c) O ânion FeBr4- faz o papel de receptor de próton:
11 – Mecanismo da nitração
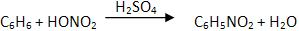
Etapas:
a) Quando há ácido sulfúrico, o ácido nítrico irá ter a função de base.
Vejamos:
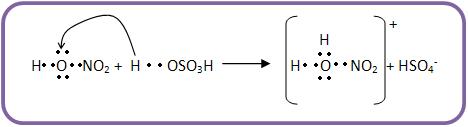
O íon oxônio irá se decompor, para formar água e o íon nitrônio.
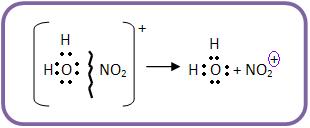
b) O íon nitrônio NO2+ (eletrófilo) irá atacar o benzeno. No fim da nitração, o íon HSO4- funcionará como receptor de próton:
Vejamos:
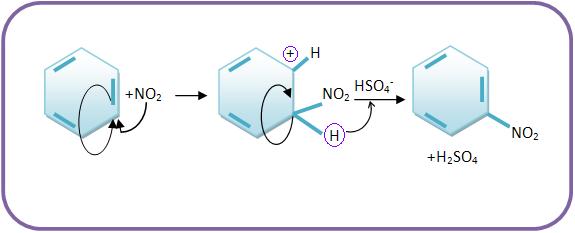
Etapas:
a) Quando há ácido sulfúrico, o ácido nítrico irá ter a função de base.
Vejamos:

O íon oxônio irá se decompor, para formar água e o íon nitrônio.

b) O íon nitrônio NO2+ (eletrófilo) irá atacar o benzeno. No fim da nitração, o íon HSO4- funcionará como receptor de próton:
Vejamos:

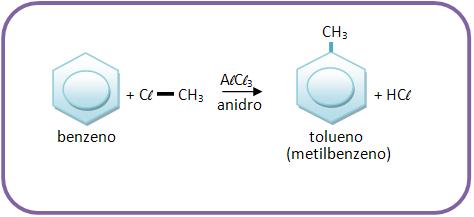
12 – Reação de Fiedel–Crafts.
Um cloreto de alcoíla (R – Cl) reagirá com o benzeno, na presença de uma pequena quantidade de cloreto de alumínio anidro, para resultar em alquibenzeno.
Etapas:
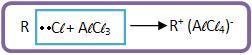
a) Um complexo iônico é formado pelo haleto de alquila e pelo catalisador (ácido de Lewis).
Vejamos:
b) O benzeno é atacado pelo íon positivo R+ (eletrofílico)
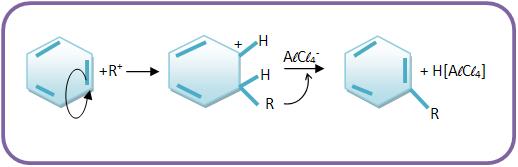
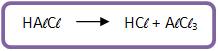
A reação de Fiedel–Crafts é um processo de obtenção de hidrocarbonetos aromáticos.
13 – Grupos dirigentes
Alguns exemplos de hidrocarbonetos aromáticos:
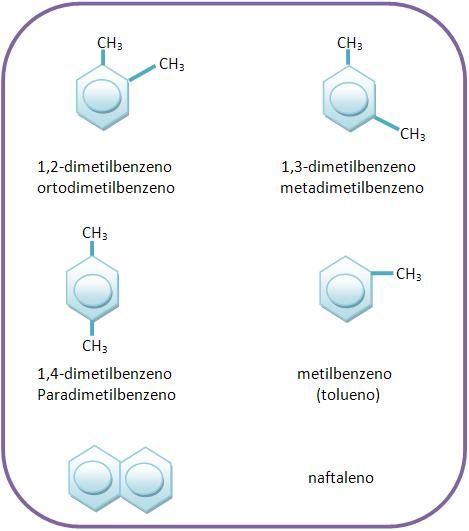
Quando houver uma cadeia lateral ou um grupamento funcional em um composto aromático, eles irão ser chamados de grupos dirigentes, onde eles podem ser agrupados em duas classes, que veremos nos próximos tópicos de nosso curso.
14 – Grupos dirigentes de primeira classe ou grupos orto e paradirigentes
Os grupos dirigentes de primeira classe são grupos que orientam as substituições para as posições orto e paradirigentes, quando estão ligados com o núcleo aromático. Estes grupos podem ser representados por Y.
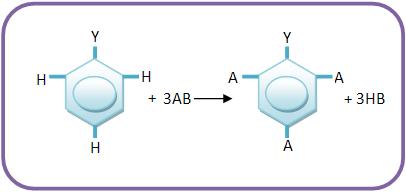
Vejamos os grupos dirigentes de 1° classe em ordem decrescente de sua força dirigente:
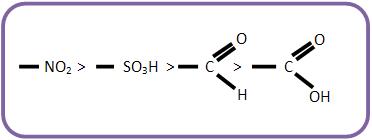
15 – Grupos dirigentes de segunda classe ou grupos metadirigentes
Os grupos dirigentes de segunda classe são grupos que orientam as substituições para as posições meta, quando estão ligados com o núcleo aromático. Estes grupos podem ser representados por Z.
Vejamos:
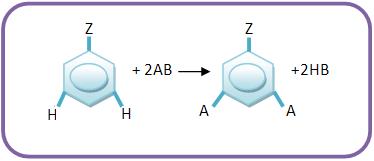
Vejamos os grupos dirigentes de 2° classe em ordem decrescente de sua força dirigente:
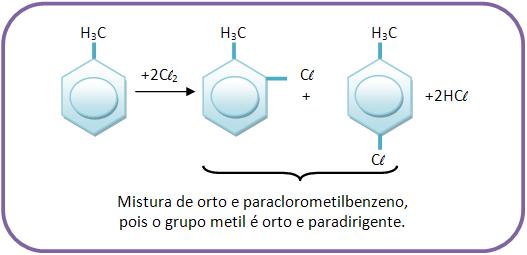
A monocloração (introdução de um átomo de cloro) do metilbenzeno produz:
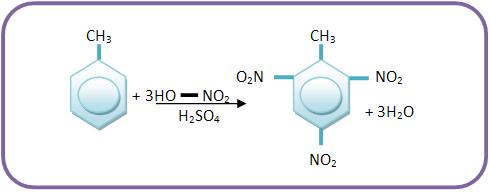
O trinitrotolueno é produzido pela trinitração do tolueno, que é usado como explosivo.
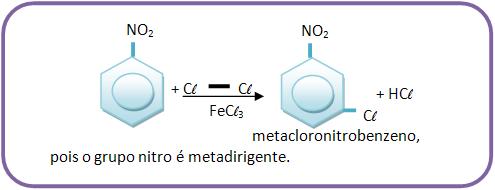
A monocloração do nitrobenzeno produz:
A monocloração do nitrobenzeno produz:
16 – Reatividade e orientação na substituição eletrófila
A) Grupos desativantes
Todos os grupos que estiverem ligados ao núcleo benzênico serão considerados elétrons atraentes e irão orientar a introdução de outro grupo para a posição meta. Estes grupos irão desativar o núcleo benzênico e com isso diminuir a velocidade da reação, como exemplo, podemos citar o nitrobenzeno, que é quase um milhão de vezes menos reativo do que o benzeno.
Esse núcleo benzênico irá ser atacado pelo cátion B+, ou seja, um grupo elétron atraente que pode puxar elétrons deste núcleo, fazendo com que ele fique menos suscetível ao ataque do cátion B+ e mais positivo.
Os metas são orientados pelos grupos insaturados ou por grupos que possuem ligação dativa.
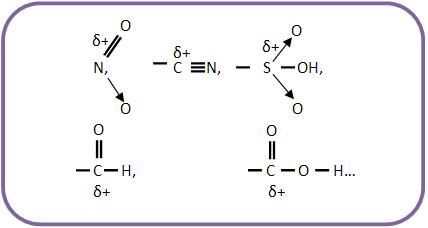
O átomo que está ligado ao núcleo benzênico, fica polarizado positivamente. Esse grupo pode puxar elétrons do núcleo benzênico.
Mesmo que o grupo abaixo seja saturado, ele é desativante, pois o carbono pode estar polarizado positivamente.
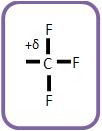
B) Grupos ativantes
Todos os grupos que estiverem ligados ao núcleo benzênico serão considerados elétrons repelentes e irão orientar a entrada de outro grupo para as posições orto ou paradirigentes. Estes grupos irão ativar o núcleo benzênico e com isso aumentar a velocidade da reação, como exemplo, podemos citar a anilina, que é quase um milhão de vezes mais ativa que o benzeno.
Esse grupo de elétrons que repelem, tem a intenção de empurrar os elétrons direto para o núcleo benzênico, fazendo com que ele fique mais suscetível ao ataque do cátion B+, e mais negativo.
Esses grupos saturados orientam as posições para os paradirigentes e orto.
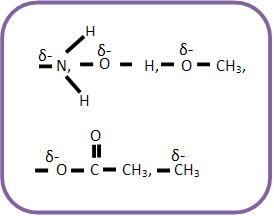
O átomo ligado ao núcleo benzênico fica polarizado negativamente. Esse grupo pode empurrar elétrons para o núcleo benzênico.
A) Grupos desativantes
Todos os grupos que estiverem ligados ao núcleo benzênico serão considerados elétrons atraentes e irão orientar a introdução de outro grupo para a posição meta. Estes grupos irão desativar o núcleo benzênico e com isso diminuir a velocidade da reação, como exemplo, podemos citar o nitrobenzeno, que é quase um milhão de vezes menos reativo do que o benzeno.
Esse núcleo benzênico irá ser atacado pelo cátion B+, ou seja, um grupo elétron atraente que pode puxar elétrons deste núcleo, fazendo com que ele fique menos suscetível ao ataque do cátion B+ e mais positivo.
Os metas são orientados pelos grupos insaturados ou por grupos que possuem ligação dativa.

O átomo que está ligado ao núcleo benzênico, fica polarizado positivamente. Esse grupo pode puxar elétrons do núcleo benzênico.
Mesmo que o grupo abaixo seja saturado, ele é desativante, pois o carbono pode estar polarizado positivamente.

B) Grupos ativantes
Todos os grupos que estiverem ligados ao núcleo benzênico serão considerados elétrons repelentes e irão orientar a entrada de outro grupo para as posições orto ou paradirigentes. Estes grupos irão ativar o núcleo benzênico e com isso aumentar a velocidade da reação, como exemplo, podemos citar a anilina, que é quase um milhão de vezes mais ativa que o benzeno.
Esse grupo de elétrons que repelem, tem a intenção de empurrar os elétrons direto para o núcleo benzênico, fazendo com que ele fique mais suscetível ao ataque do cátion B+, e mais negativo.
Esses grupos saturados orientam as posições para os paradirigentes e orto.

O átomo ligado ao núcleo benzênico fica polarizado negativamente. Esse grupo pode empurrar elétrons para o núcleo benzênico.
17 – Orientação em derivados dissubstituídos do benzeno
Quando houver dois grupos ligados ao núcleo benzênico, a possibilidade da entrada de um terceiro grupo é grande.
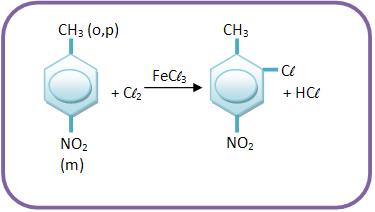
A) A ação dirigente de um grupo reforça a do outro
A ação dirigente de um grupo reforça a do outro, quando os dois grupos estão no mesmo lugar, podendo assim prever o produto principal facilmente.
Vejamos:
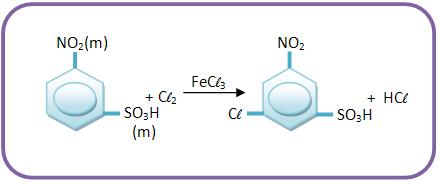
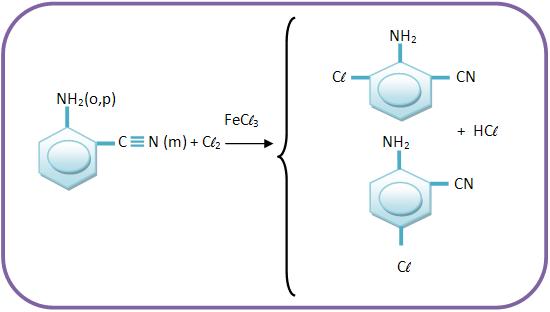
B) A ação dirigente de um grupo se opõe à do outro
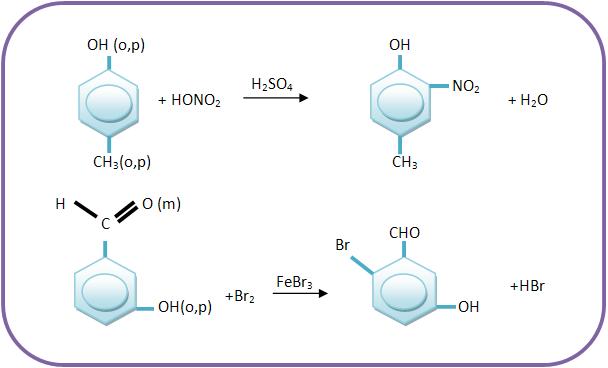
A ação dos grupos que são fortemente ativantes se sobrepõe à ação dos grupos fracamente ativantes, onde essa ação de sobrepõe á de grupos desativantes.
Vejamos o produto principal das reações:
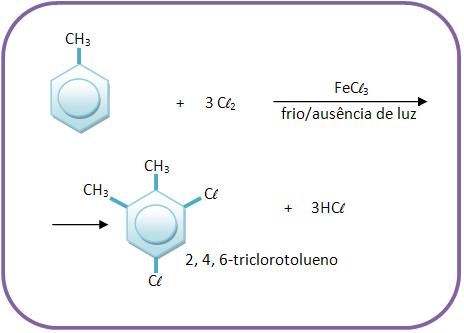
18 – Reação do tolueno com cloro
A reação do tolueno com o cloro ocorre com substituição do hidrogênio preso na cadeia lateral ou no núcleo aromático, dependendo das suas condições. Se a reação ocorrer na presença de luz ou de calor, a substituição ocorrerá no grupo – CH3 (cadeia lateral).
Regra C.C.C.: calor, claridade, cadeia.
Vejamos:
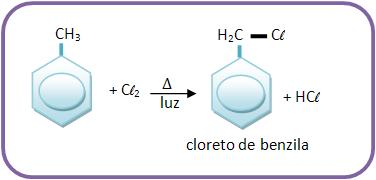
Mas se a reação de tolueno com cloro ocorrer com a ausência de luz e com a presença do frio, na presença de FeCl3 como catalisador, a substituição será feita no núcleo aromático.
A substituição será dividida pelo – CH3 (grupo paradirigente e orto).
Regra N.N.N.: noite, neve, núcleo.
Vejamos:
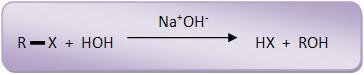
19 – Reações de substituição em derivados halogenados
O estudo cinético de uma reação se resume em medir a sua velocidade, analisando assim os fatores que possam diversificar essa velocidade.
Devemos considerar a hidrólise alcalina dos compostos abaixo, para que possamos observar a reatividade dos derivados halogenados:
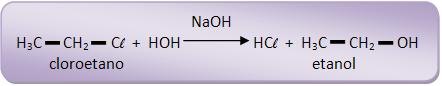
20 – Mecanismos de substituição em derivados halogenados
Na reação de substituição nucleofílica (S.N.), quem ataca o composto orgânico é o íon OH- (base de Lewis), considerado um reagente nucleófilo.
A) Mecanismo de hidrólise do brometo de metila (heleto de alcoíla primário)

Caminho da reação
I) Aproximação dos reagentes
Um átomo de bromo, eletrizado negativamente, repele o ânion OH- , atacando a molécula pelo outro lado.
II) Formação de um complexo ativado:
Neste complexo, a ligação HO – C começa a se formar, enquanto a ligação C – Br começa a se romper.
É necessária uma energia ∆Ha para formar o complexo, pois as ligações do carbono com os átomos de hidrogênio foram distorcidos.
III) Separação dos produtos:
Os átomos de hidrogênio estão em posições estáveis.
O mecanismo é SN – 2, isto é, substituição nucleofílica de segunda ordem, ou seja, a velocidade da reação irá depender da concentração de R– X de OH-.
V = k [R – X] [OH-]
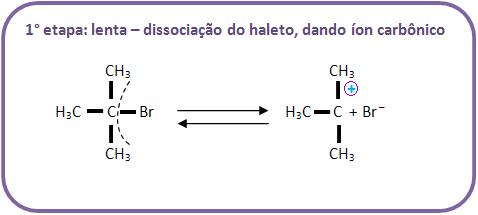
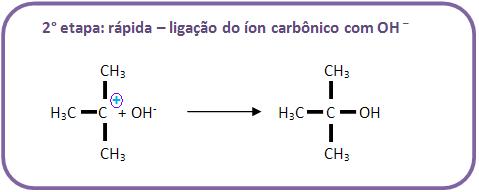
B) Mecanismo de hidrólise do brometo de tercbutila (haleto de alcoíla terciário)
Através de um mecanismo diferente chamado SN-1 (substituição nucleofílica de primeira ordem), a hidrólise dos haletos de alcoíla terciários irá se processar.
É difícil o ataque do OH- pelo lado oposto, pelo fato de haver um impedimento estérico (espacial) disposto pelos 3 grupos. Portanto, podemos concluir que o mecanismo é diferente e ocorre da seguinte maneira, vejamos:
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário