1 – Ruptura de uma ligação
Os compostos orgânicos realizam suas reações através das rupturas de ligações e também pela formação de novas ligações.
O composto AB, a ligação entre os dois átomos A e B pode ser rompida pela cisão homolítica ou pela cisão heterolítica, vejamos:
Cisão homolítica (homólise)
Cada átomo leva o seu elétron, obtendo como resultado dois radicais (átomos com elétrons não-emparelhados).
Vejamos:

Esta ruptura acontece através da ação da luz, do calor ou de reativos que contenham elétrons desemparelhados, como o oxigênio e produtos de decomposição de peróxidos. Comum acontecer na fase gasosa.
Cisão heterolítica (heterólise)
O par eletrônico fica apenas com um átomo.
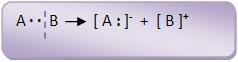
Essas reações costumam acontecer em solução e são catalisadas pelos ácidos ou pelas bases. Não são afetadas por luz, oxigênio ou peróxidos.
Essa cisão ocorre quando a reação acontece em um líquido polar, isto é, líquido constante dielétrica elevada.
Os compostos orgânicos realizam suas reações através das rupturas de ligações e também pela formação de novas ligações.
O composto AB, a ligação entre os dois átomos A e B pode ser rompida pela cisão homolítica ou pela cisão heterolítica, vejamos:
Cisão homolítica (homólise)
Cada átomo leva o seu elétron, obtendo como resultado dois radicais (átomos com elétrons não-emparelhados).
Vejamos:

Esta ruptura acontece através da ação da luz, do calor ou de reativos que contenham elétrons desemparelhados, como o oxigênio e produtos de decomposição de peróxidos. Comum acontecer na fase gasosa.
Cisão heterolítica (heterólise)
O par eletrônico fica apenas com um átomo.
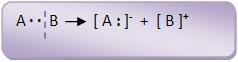
Essas reações costumam acontecer em solução e são catalisadas pelos ácidos ou pelas bases. Não são afetadas por luz, oxigênio ou peróxidos.
Essa cisão ocorre quando a reação acontece em um líquido polar, isto é, líquido constante dielétrica elevada.
2- Reagente nucleófilo
Reagente nucleófilo também é conhecido como nucleofílico, estes são favoráveis ao núcleo como uma espécie de molécula ou íon, capaz de oferecer um par de elétrons para a formação de uma ligação.
Os nucleófilos são bases de Lewis.
Reagente nucleófilo também é conhecido como nucleofílico, estes são favoráveis ao núcleo como uma espécie de molécula ou íon, capaz de oferecer um par de elétrons para a formação de uma ligação.
Os nucleófilos são bases de Lewis.
3-Reagente eletrófilo
Reagente eletrófilo também é conhecido como eletrofílico é favorável ao elétron, como uma espécie capaz de formar uma nova ligação, aceitando um par de elétrons. Os eletrófilos são ácidos de Lewis.
4-Radical livre
Radical livre é uma espécie que possui elétron desemparelhado, onde o radical livre é eletricamente neutro.
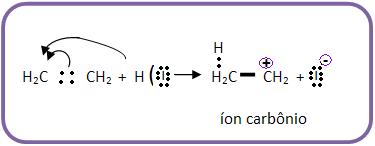
5-Adição eletrofílica
Exemplo:
a) Heterólise do HI e ataque do H+ (eletrófilo) ao composto orgânico. O cátion de carga positiva em átomo de carbono é denominado como genérico de íon carbônio.
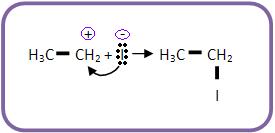
b) Combinação do íon carbônio com o I- (nucleófilo)
6-Adição nucleofílica
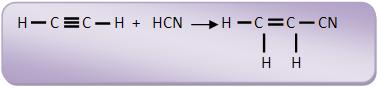
Mecanismo:
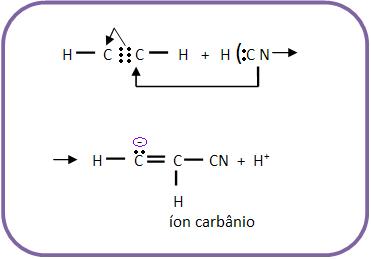
a) Heterólise do HCN e ataque o CN- (nucleófilo) ao composto orgânico. O ânion de carga negativa em átomo de carbono é denominado como genérico de íon carbânio.
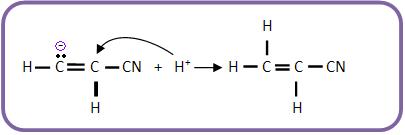
b) Combinação do íon carbânio com H+ (eletrófilo).
7-Substituição por radicais livres
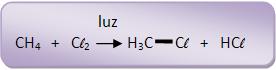
Mecanismo
a) Homólise do Cl2 sob a ação de luz ou calor.
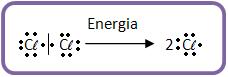
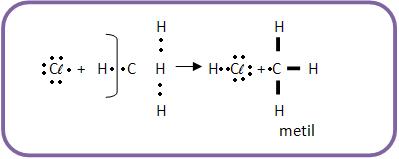
b) Ataque ao CH4 através do átomo de cloro, formando radical metila.
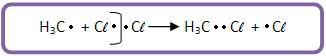
O radical metil ataca uma molécula de Cl2. A reação continua em cadeia.
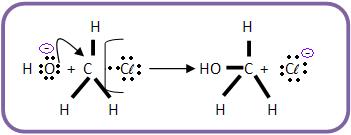
8-Substituição nucleofílica
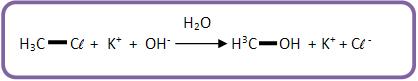
Mecanismo
Ataque do OH- (nucleófilo) ao H3C – Cl.
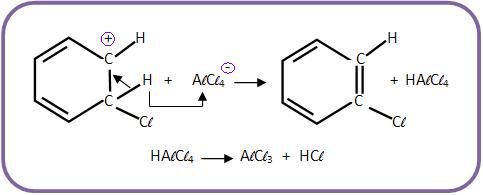
9-Substituição eletrofílica
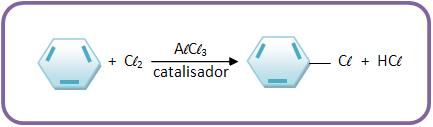
Mecanismo
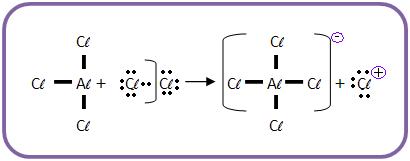
a) O catalisador irá combinar com Cl2.
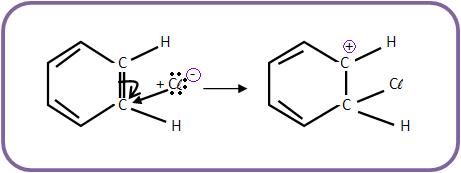
b) O Cl+ (eletrófilo) atacará o núcleo benzênico.
c) O íon carbônio perderá próton (H+) para o AlCl4- e o catalisador irá se regenerar.
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário