A combustão é considerada uma reação de oxirredução que ocorre na presença do oxigênio. Todos os compostos orgânicos sofrem a combustão completa, resultando em gás carbônico e água.
Em outros casos pode-se formar um terceiro composto.
CH4 + 202 → CO2 + 2H2O
metano
C2H5OH + 3O2 → 2CO2 + 3H2O
etanol
Vejamos algumas equações gerais de combustão:
• alcanos:

• alcenos:
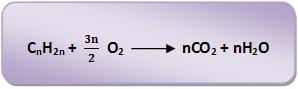
• Alcinos:

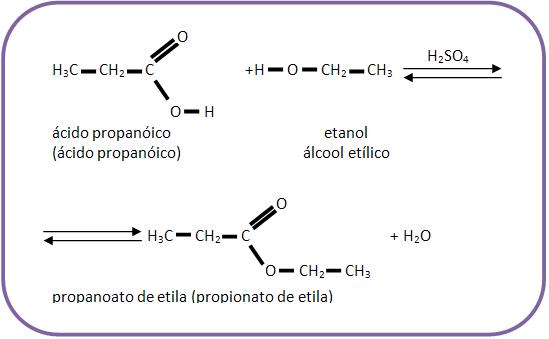
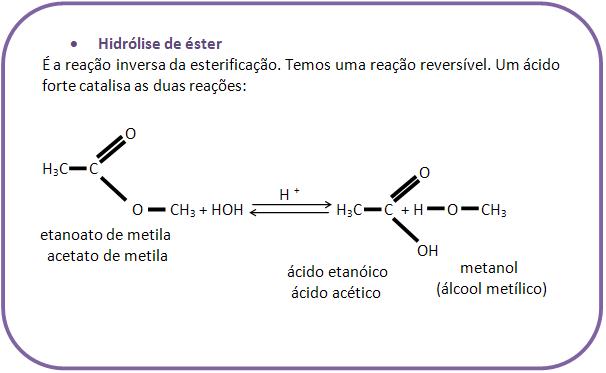
2 – Reação de esterificação
A reação de esterificação é considerada uma reação reversível de álcool junto com um ácido orgânico ou inorgânico, produzindo éster e água. Já quando areação é inversa, ela é denominada hidrólise do éster.
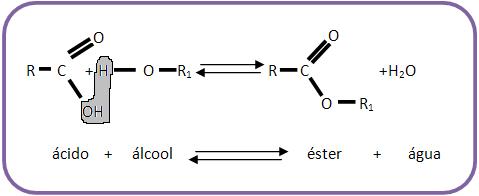
O equilíbrio pode ser deslocado para o lado do éster, quando se ajunta com o desidratante. Durante o experimento ficou comprovado que na reação de esterificação o oxigênio do grupo OH do álcool continua na molécula do éster e o oxigênio do grupo OH do ácido é eliminado sob a forma de H2O (água), produzindo a reação de um álcool marcado:
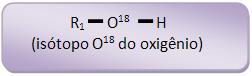
Com ácido, observa-se a forma do éster marcado, e não água, contendo assim O – 18.
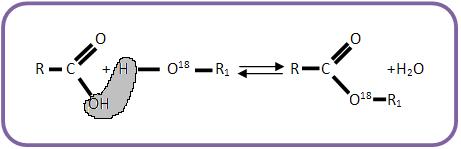
Para acelerar a reação, usa-se o ácido como catalisador.
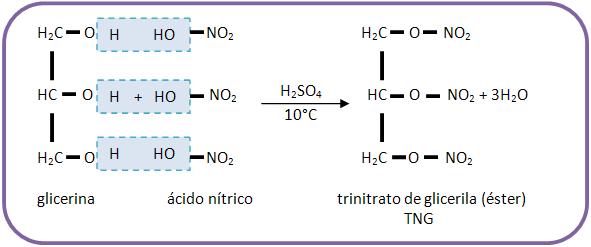
3 – Dinamite
Todo o trinitrato de glicerina, que é absorvido no material poroso recebe o nome de dinamite. Esse trinitrato é muito sensível ao choque. Alfred Nobel, um engenheiro sueco, descobriu que quando a nitroglicerina é absorvida em qualquer material poroso, diminui-se a sensibilidade à explosão, sendo possível o seu emprego como explosivo.
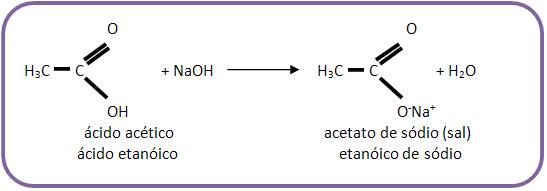
4 – Reações com base
• Ácido carboxílico
Ácido carboxílico tem reação de neutralização.
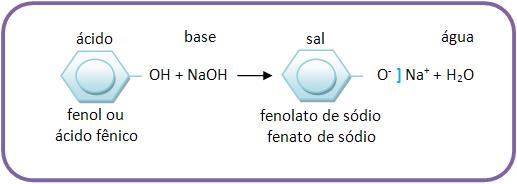
• Fenol
Fenol apresenta caráter ácido, diferenciando fenol de álcool, pois o álcool não reage com base.
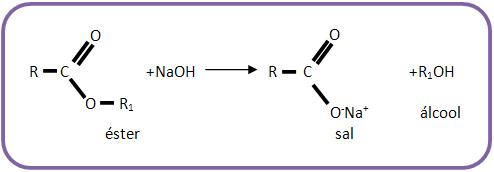
• Éster
Éster é conhecida como reação de saponificação (formação de sabão).
Observação:
O sal que se forma nesta reação se for derivado de ácido graxo (ácido carboxílico de cadeia longa) recebe o nome de sabão.
Os sabões e detergentes estabelecem emulsão. Os ácidos sulfônicos e seus derivados recebem o nome particular de detergente.
5 – Reações com ácido
Caráter básico das aminas
As aminas quando estão na presença de água se comportam como NH3 e apresentam características alcalinas. Tanto o N da amina, quanto o do NH3, apresenta um par eletrônico livre podendo assim receber um próton (H+), apresentando um caráter básico.
Portanto podemos concluir que é por este motivo que todas as aminas são chamadas de bases orgânicas.
Caráter básico das aminas
As aminas quando estão na presença de água se comportam como NH3 e apresentam características alcalinas. Tanto o N da amina, quanto o do NH3, apresenta um par eletrônico livre podendo assim receber um próton (H+), apresentando um caráter básico.
Portanto podemos concluir que é por este motivo que todas as aminas são chamadas de bases orgânicas.
6 –Ácidos e bases orgânicos
Os álcoois são considerados substâncias neutras e os ácidos carboxílicos são considerados ácidos fracos. O caráter de um grupo – OH é influenciado pela estrutura circundante.
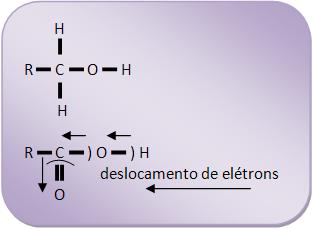
O deslocamento de elétrons no sentido indicado, é causado pela substituição de 2H por um átomo de oxigênio, fazendo com que a polarização da ligação O - H aumente, fazendo com que a ionização do H se torne mais fácil.
Para que os ácidos fortes formem bases comjugadas estáveis, eles devem se ionizar. Já os ácidos fracos possuem bases conjugadas de apenas um álcool e de um ácido carboxílico.
Vejamos:
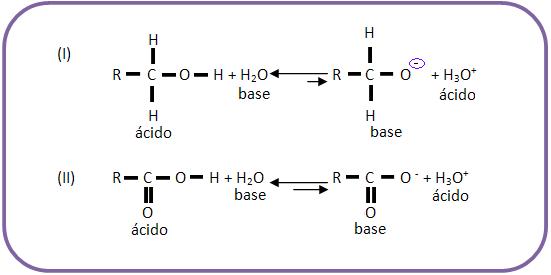
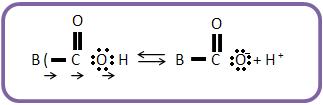
O ânion carboxilato é mais estável que o ânion alcóxido, o equilíbrio II está mais para a direita que o equilíbrio I. O ácido mais forte é o RCOOH (cede próton mais facilmente) que o álcool RCH2OH.
Os álcoois são considerados substâncias neutras e os ácidos carboxílicos são considerados ácidos fracos. O caráter de um grupo – OH é influenciado pela estrutura circundante.

O deslocamento de elétrons no sentido indicado, é causado pela substituição de 2H por um átomo de oxigênio, fazendo com que a polarização da ligação O - H aumente, fazendo com que a ionização do H se torne mais fácil.
Para que os ácidos fortes formem bases comjugadas estáveis, eles devem se ionizar. Já os ácidos fracos possuem bases conjugadas de apenas um álcool e de um ácido carboxílico.
Vejamos:

O ânion carboxilato é mais estável que o ânion alcóxido, o equilíbrio II está mais para a direita que o equilíbrio I. O ácido mais forte é o RCOOH (cede próton mais facilmente) que o álcool RCH2OH.
8 – Efeito indutivo
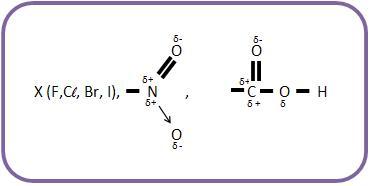
O ácido A – COOH, onde o grupo que atraí elétrons é A. O que provoca o deslocamento secundário dos elétrons das ligação C – O e O – H, facilitando separação do hidrogênio como próton é o delocamento indutivo do par de elétrons compartilhado por A e o átomo de carbono em direção a A.
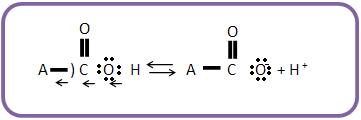
O grupo B, que repele elétrons irá produzir um deslocamento em sentido oposto, diminuindo o grau de ionização.
Grupos elétron-atraentes
Grupos elétron-repelentes
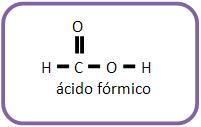
Os ácidos monocarboxílicos, o fórmico é o mais forte (Ki a 25° é 1,8 x 10 – 4).
Os ácidos dicarboxílicos, o oxálico tem maior força ácida (Ki = 6 x 10– 2 ).

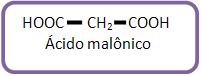
A cadeia aumenta através da introdução de grupos – CH2 – entre as carboxilas, diminuindo a força do ácido. Ki do ácido malônico: 1,8 x 10-3.
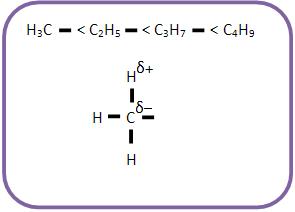
O ácido acético é mais fraco do que o ácido fórmico, por isso o grupo – CH3 é menos elétron-atraente que o átomo de hidrogênio, isto é, o grupo metila é elétron-repelente.
A força de um ácido carboxílico aumenta através da substituição de H do carbono α (carbono vizinho à carboxila) por grupos elétron-atraentes.
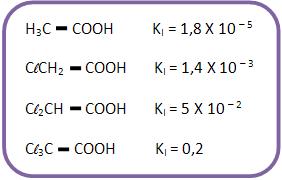
Com o aumento da distância do grupo elétron-atraente à carboxila, começa a diminuir a força ácida.
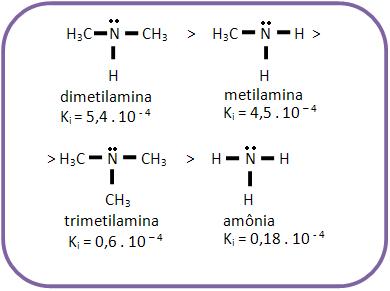
9 – Força básica das aminas
As aminas, assim como o amoníaco, apresentam reação alcalina em solução aquosa e podem se fixar à um próton, por terem um par de elétrons não-compartilhado do nitrogênio.
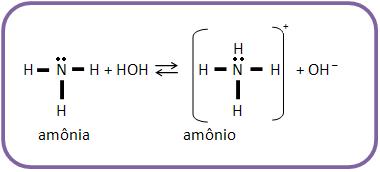

As bases mais fortes que o amoníaco são denominadas aminas alifáticas, pelo fato da afinidade do nitrogênio por próton aumentar por causa do efeito elétron-repelente dos grupos alquila. O próton é atraído com maior intensidade devido o aumento da densidade eletrônica N.
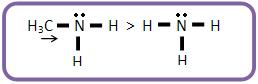
A trimetilamina é mais fraca que a metilamina e a dimetillamina, mesmo apresentando 3 grupos – CH3 elétron-repelentes, devido a um impedimento espacial (efeito estérico).
Os grupos – CH3 dificultam o ataque do próton ao par eletrônico do nitrogênio.
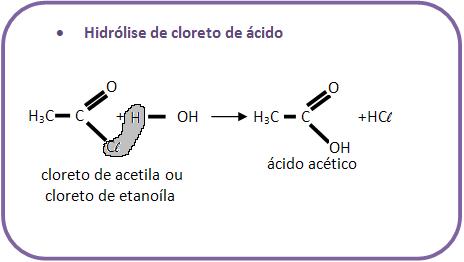
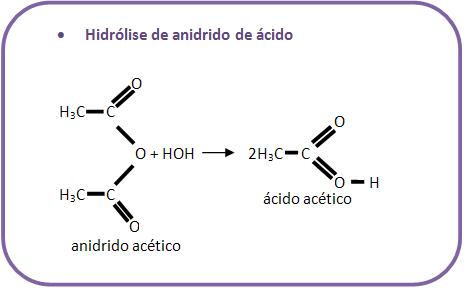
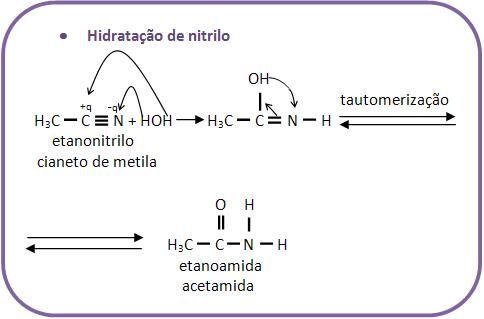
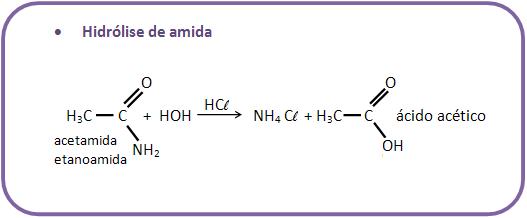
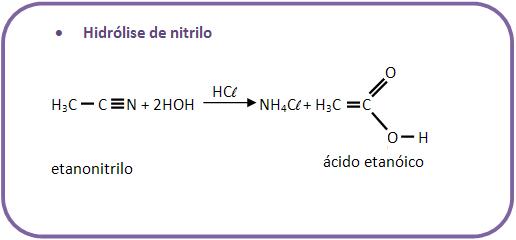
10 – Reações com água
Existem diversas reações de compostos orgânicos com água.
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário