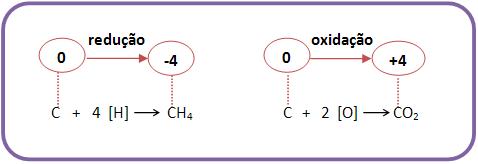
As reações de oxidorredução ocorrem com mudanças de número de oxidação. A oxidorredução é provocada pelas reações com oxigênio (oxidação) e com hidrogênio (redução).
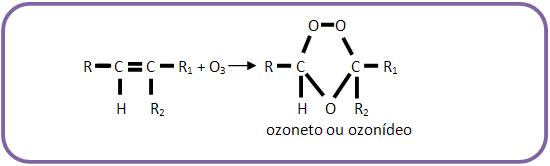
2 – Ozonólise de alcenos
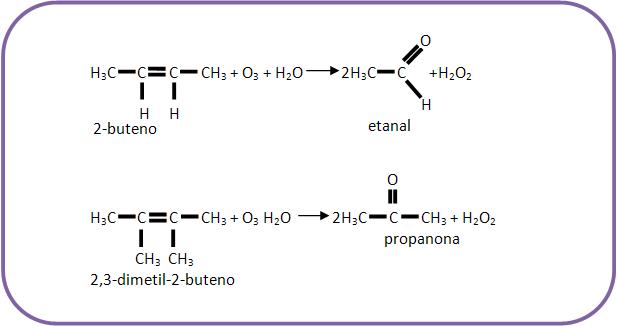
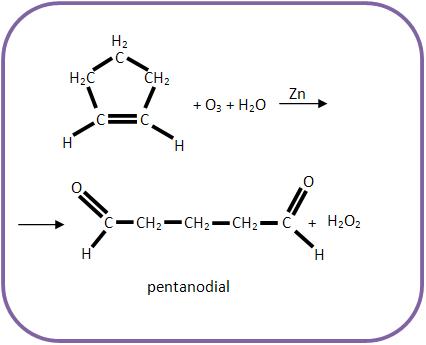
Os alcenos adicionam ozone (O3) formando ozonetos (ou ozonídeos) e por hidrólise produzem aldeídos ou cetonas.
Se os átomos de carbono da dupla ligação estiverem ramificados, serão classificados como cetonas, já se não estiverem ramificados, serão classificados como aldeídos. Pode haver casos em que um dos átomos de carbono da dupla ligação apresenta ramificação e o outro não, desta forma teremos uma mistura de aldeídos e cetonas.
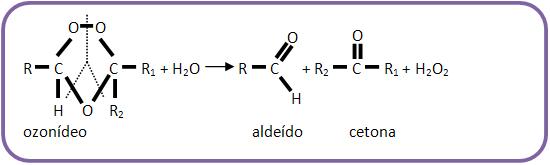
Somando as duas equações, teremos:
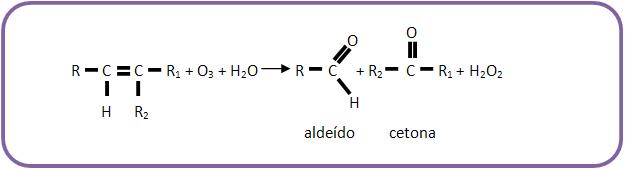
Veremos agora alguns exemplos de alcenos submetidos à ozonólise, representando apenas a equação final do processo.
3 – Aplicações da ozólise
1) Método de obtenção de aldeídos e cetonas.
2) Determinação da posição da dupla ligação na molécula.
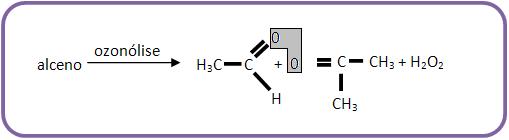
Eliminando os átomos de oxigênio das duas moléculas resultantes, deve-se unir pela dupla ligação os átomos de carbono dos grupos funcionais.
Exemplo:
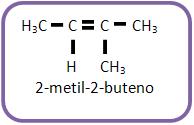
Se um alceno fornecer ao ozonólise aldeído acético e propanona. Qual será o alceno?
Portanto o alceno é:
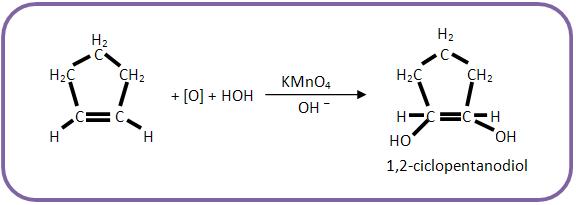
4 – Oxidação branda de alcenos
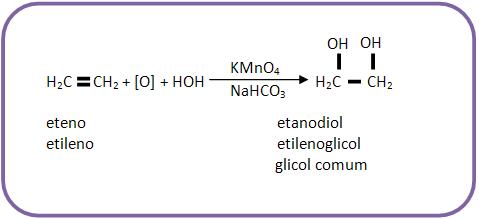
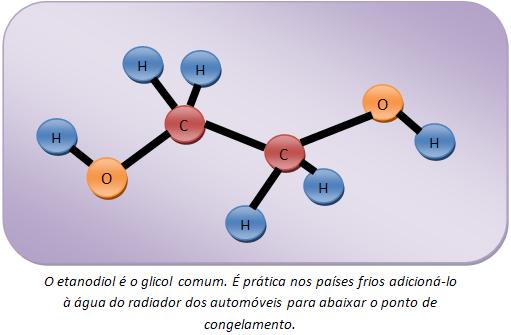
Os alcenos são todos oxidados pelo KMnO4 em meio básico (NaHCO3 ou Na2CO3) ou em meio neutro, formando diálcoois vicinais chamados glicóis.
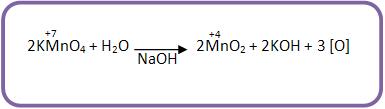
O oxidante brando mais usado é o KMnO4/NaHCO3 , que é conhecido como Reativo de Baeyer.
Em meio alcalino, o KMnO4 é um oxidante brando:
Vejamos:
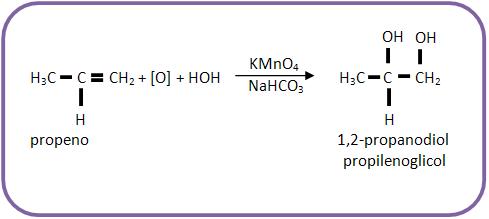
Exemplos de oxidação branda de alcenos:
5 – Oxidação enérgica
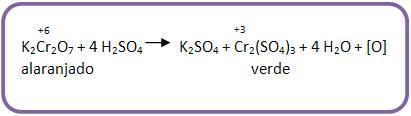
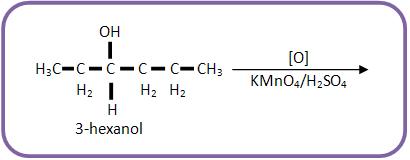
Oxidação enérgica são exemplos de oxidantes enérgicos, como a mistura sulfopermangânica (KMnO4/H2SO4) e mistura sulfocrômica (K2Cr2O7/H2SO4).
O KMnO4, em meio ácido sulfúrico, é considerado um oxidante enérgico:
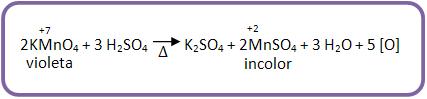
Pode-se notar que a solução KMnO4 perde a cor, pois na reação a solução de cor violeta fica incolor.
Pode-se notar que com o K2Cr2O7 acontece reação parecida:
Vejamos:
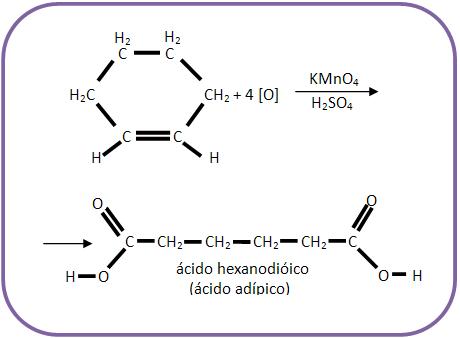
6 – Oxidação enérgica de alcenos
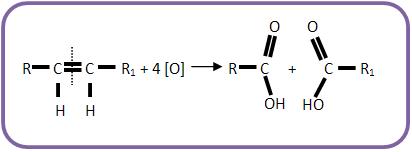
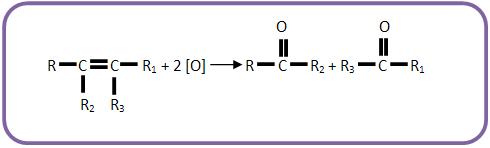
Se o alceno for submetido a um oxidante enérgico e sofrer oxidação com ruptura da dupla ligação, poderá haver a formação de ácidos carboxílicos, cetonas ou gás carbônico:
Vejamos:
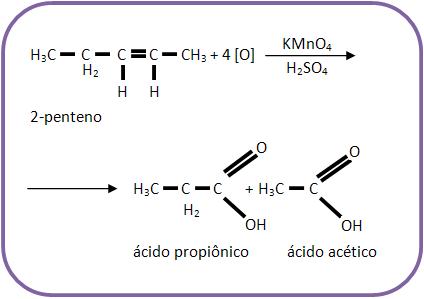
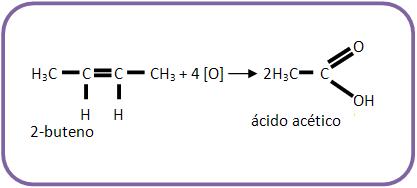
Caso a dupla ligação esteja no meio da cadeia carbônica, obteremos apenas um ácido carboxílico.
Vejamos:
Já por apresentar um caráter redutor, o ácido fórmico será oxidado a CO2 + H2O.
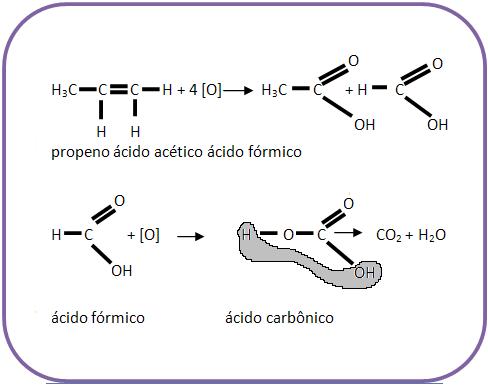
Se o alceno apresentar ramificações nos átomos de carbono da dupla ligação, teremos cetona em vez de ácido carboxílico.
7 – Aplicação da oxidação enérgica
Determinação da posição da dupla ligação na molécula.
Por exemplo:
Oxidação enérgica de um alceno, a formação de acetona como único produto carbonado.
Qual será o alceno?
Vejamos:
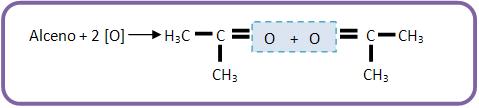
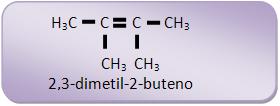
O alceno é:
8 – Oxidações nos cicloalcenos
Os cicloalcenos apresentam reações de oxidação parecidas com as dos alcenos.
A) Ozonólise do ciclopenteno
B) Oxidação enérgica
C) Oxidação branda do ciclopenteno (Baeyer)
9 – Oxidação enérgica de ciclanos
Na solução aquosa, os ciclanos resistem ao KMnO4, usado na diferenciação com alcenos.
Na presença de oxidante enérgico (HNO3 concentrado, KMnO4 em meio ácido), obtém-se a ruptura do ciclo, formando o ácido dicarboxílico.
10 – Oxidação enérgica de hidrocarbonetos aromáticos
O ácido benzóico é formado a partir de hidrocarbonetos benzênicos junto com um grupo lateral. A ação dos oxidantes como mistura sulfocrômica e mistura sulfopermangânica, são suportadas pelo núcleo aromático.
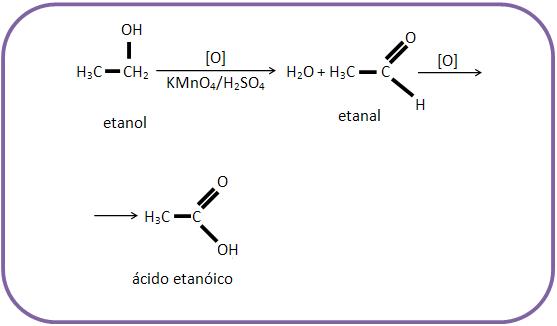
11 – Oxidação enérgica de alcoóis
Um álcool primário quando está na presença do oxidante é oxidado a ácido carboxílico, já o álcool secundário, forma-se cetona, onde a oxidação da cetona só acontece nas condições energéticas e os terciários só irão se oxidar com oxidantes muito energéticos.
Oxidação de álcool primário na presença de mistura sulfopermangânica ou sulfocrômica:
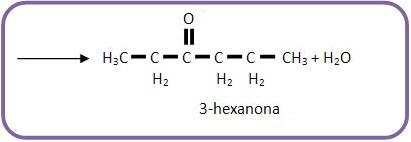
Oxidação de álcool secundário:
12 – Diferenciação prática de aldeídos e cetonas
O aldeído pode ser oxidado com facilidade, já a cetona tem dificuldade de ser oxidado. Para diferenciá-las, basta usar um oxidante.
13 – Reativo de Tollens
O reativo de Tollens é uma solução amoniacal de nitrato de prata, utilizada para diferenciar aldeídos de cetonas.
Os aldeídos produzem um precipitado de prata metálica nas paredes do frasco, formando um espelho de prata.
As cetonas não reagem com reativo de Tollens.

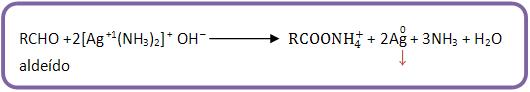
O cátion Ag+ é reduzido pelo aldeído à prata metálica. O aldeído é oxidado a ácido carboxílico.
O reativo de Tollens é uma solução amoniacal de nitrato de prata, utilizada para diferenciar aldeídos de cetonas.
Os aldeídos produzem um precipitado de prata metálica nas paredes do frasco, formando um espelho de prata.
As cetonas não reagem com reativo de Tollens.

O cátion Ag+ é reduzido pelo aldeído à prata metálica. O aldeído é oxidado a ácido carboxílico.
14 – Reativo de Fehling
Este reativo é considerado uma mistura de solução alcalina de tartarato duplo de sódio, potássio e solução de CuSO4, apresentando uma cor azul-escura, que possui um íon complexo de cobre II.
A solução a ser testada é aquecida junto ao licor de Fehling, em um precipitado de cor vermelho-marrom de óxido cuproso, indicando a presenca de um aldeído.
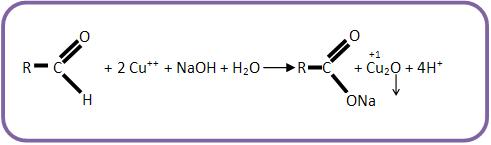
As cetonas não produzem precipitado, pois não reagem com o licor de Fehling.
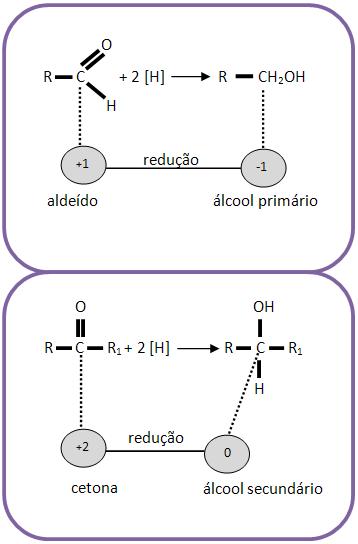
15 – Redução de aldeídos e cetonas
Através da redução com o hidrogênio, um aldeído pode produzir álcool primário, já a cetona pode produzir álcool secundário.
Com a presença de Pt ou Ni como catalisadores, o hidrogênio poder ser considerado molecular ou nascente.
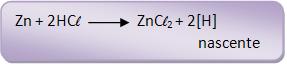
O número de oxidação do carbono do grupo funcional diminui:
Vejamos:
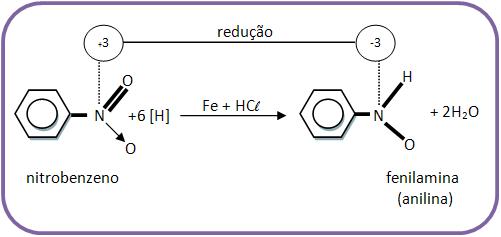
16 – Redução de compostos nitrogenados
A produção de amina se dá através da redução de um composto nitrogenado. A anilina é formada pela redução de nitrobenzeno, ela sofre oxidação muito fácil, e passa à apresentar cor diferente.
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário