Uma reação química indica o rearranjo de elétrons e núcleos de uma estrutura, para constituir uma nova estrutura. As transformações estruturais são seguidas de absorção ou escape de energia sob várias formas.
Energia de um sistema é quando o sistema é capaz de executar trabalho. A energia pode se apresentar de várias formas.
O calor é um exemplo de energia. Uma quantidade de calor é mensurada em joule, ou em:
- Caloria (cal): é a quantidade de calor fornecida a 1g de água para elevar sua temperatura em 1°C.
1cal = 4,185J
- Quilocaloria (kcal ou Cal) = 1000 calorias
Calor específico é a quantidade de calor, característica de cada substância, necessária para que 1g de substância sofra variação de temperatura de 1°C.
O calor específico do ferro é aproximadamente 0,11cal/g.°C, isto é, 1g de ferro necessita de 0,11cal para elevar sua temperatura de 1°C.
A capacidade térmica de uma substância é equivalente ao calor específico multiplicado pela massa de substância (m . c).
A capacidade térmica é o quociente entre a quantidade Q de calor recebida ou cedida por um corpo e a correspondente variação de temperatura.
Lei de Dulong e Petit
“Para muitos elementos sólidos, a capacidade térmica atômica é aproximadamente 6,4.”
Onde:
A = massa molar do elemento
c = calor específico
Reações exotérmicas e endotérmicas
2. Reações exotérmicas e endotérmicas
Quando há liberação de calor, o processo é chamado de exotérmico; e quando há absorção de calor dizemos que o processo é endotérmico.
Exemplos:
Reação exotérmica
C(grafita) + O2(g) → CO2(g) + 94,1kcal
Na reação acima, 1 mol de CO2(gás) é formado a partir de grafita e oxigênio, ocorrendo a liberação de 94,1kcal.
Podemos representar as reações exotérmicas através do gráfico abaixo:
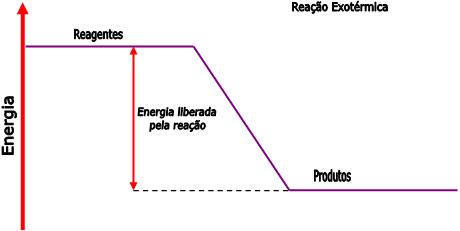
Veja que no gráfico acima, que os produtos são menores que o conteúdo energético dos reagentes.
Numa reação exotérmica, o calor é escrito assim como um produto.
A + B → C + D + x kcal
Reação endotérmica
H2(g) + I2(s) + 12,4 kcal → 2HI(g)
ou
H2(g) + I2(s) → 2 HI(g) - 12,4 kcal
Na reação acima, quando 2 mols de HI (gás) se formaram a partir de hidrogênio e iodo cristalino foram absorvidas 12,4 kcal.
No processo da reação endotérmica é necessário um fornecimento externo de energia. Sendo assim, a energia armazenada dos reagentes é menor que a dos produtos.
Podemos representar as reações endotérmicas através do seguinte gráfico:
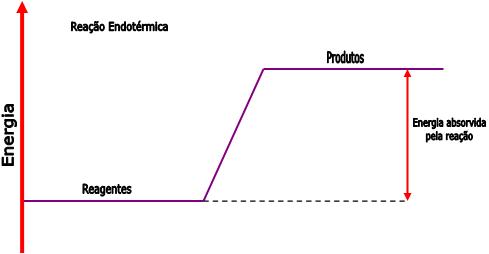
Quando há liberação de calor, o processo é chamado de exotérmico; e quando há absorção de calor dizemos que o processo é endotérmico.
Exemplos:
Reação exotérmica
C(grafita) + O2(g) → CO2(g) + 94,1kcal
Na reação acima, 1 mol de CO2(gás) é formado a partir de grafita e oxigênio, ocorrendo a liberação de 94,1kcal.
Podemos representar as reações exotérmicas através do gráfico abaixo:

Veja que no gráfico acima, que os produtos são menores que o conteúdo energético dos reagentes.
Numa reação exotérmica, o calor é escrito assim como um produto.
A + B → C + D + x kcal
Reação endotérmica
H2(g) + I2(s) + 12,4 kcal → 2HI(g)
ou
H2(g) + I2(s) → 2 HI(g) - 12,4 kcal
Na reação acima, quando 2 mols de HI (gás) se formaram a partir de hidrogênio e iodo cristalino foram absorvidas 12,4 kcal.
No processo da reação endotérmica é necessário um fornecimento externo de energia. Sendo assim, a energia armazenada dos reagentes é menor que a dos produtos.
Podemos representar as reações endotérmicas através do seguinte gráfico:

Calor de reação ou energia de reação – uma propriedade extensiva
A “energia de reação” ou “calor de reação” é a energia térmica liberada ou absorvida numa reação.
Estando todas as substâncias, desde as iniciais até as finais, com a mesma temperatura e com a mesma pressão, o calor de reação mede a diferença de energia entre os reagentes e os produtos.
O calor de reação é considerado como uma propriedade extensiva, pois é sempre proporcional à quantidade de material participante da reação.
Energia Todo sistema químico tem capacidade para armazenar energia, que pode ter sua definição atribuída conforme o mecanismo de armazenagem.
Portanto, temos: Energia Cinética, Energia Potencial Gravitacional, Energia Potencial Elétrica e Energia Química.
Energia potencial gravitacional: mecanismo: separação de massas (Lei de Newton).
Energia potencial elétrica: mecanismo: separação de cargas.
Desse modo, é preciso realizar um trabalho para separar as cargas de sinais opostos.
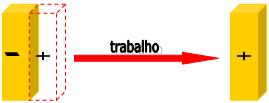
Energia química: mecanismo: separação de reagentes
Desse modo, os gases oxigênio e hidrogênio podem reagir quando se misturam, produzindo água e liberando a energia armazenada.
Energia cinética – mecanismo: movimento
Os átomos e moléculas que se movimentam possuem energia cinética.
Por exemplo: uma molécula de CO2 apresenta três tipos de movimento:
Translação: quando o movimento da molécula ocorre de um lugar para o outro.
Rotação: quando o movimento da molécula ocorre em torno de seu centro de massa.
Vibração: quando o movimento dos átomos ocorre alternadamente para perto e para longe do centro de massa.
Formas de transferência de energia
A transferência de energia para dentro e para fora do sistema é ocasionada por uma mudança na quantidade de energia armazenada nesse sistema.
Essa energia transferida é definida de acordo com as condições sob as quais a transferência ocorre:
- Trabalho (energia mecânica) – condição de transferência: mudança no movimento.
Desse modo, a liberação de energia armazenada ocorre para a realização de um trabalho.
- calor (energia térmica): condição de transferência: objetos em contato a diferentes temperaturas.
- Luz (energia radiante): condição de transferência: objetos separados a diferentes temperaturas.
- Eletricidade: condição de transferência: sistemas que produzem separação de carga.
Entalpia (H)
Entalpia é o conteúdo energético global de um sistema, ou seja, a soma da energia química e da energia térmica.
É indicada por: H
Quando há uma reação no estado do sistema, a variação de entalpia (∆H) é determinada por:
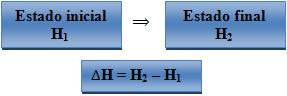
Onde:
H1 – entalpia do sistema no seu estado inicial.
H2 = entalpia do sistema no seu estado final.
Quando a pressão e a temperatura forem as mesmas desde o estado inicial até o final, o calor da reação será a mediada do ∆H.
Na reação exotérmica, temos H2 menor que H1, de modo que ∆H tem valor negativo.
Exemplo:
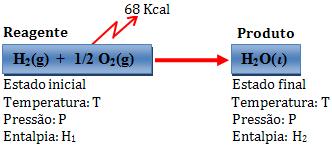
Variação de entalpia:
∆H = H2 – H1 = -68 kcal
Deste modo, um mol de água líquida possui uma energia 68 kcal a não ser que o sistema formado por 1 mol de H2 e 1/2 mol de O2 gasosos.
Através dos valores imaginários de entalpia, torna-se mais fácil para o leitor compreender o sinal de ∆H.
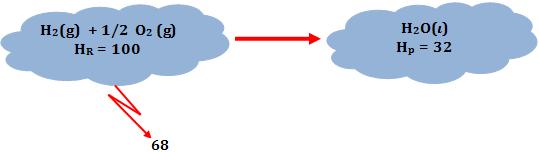
∆H = Hp – HR = 32 – 100 = - 68
Onde:
HR = entalpia dos reagentes
Hp = entalpia dos produtos
A equação pode ser escrita assim:
H2(g) + 1/2 O2(g) → H2O(l) ∆H = - 68 kcal
Normalmente, o calor de reação seria um “produto”:
H2(g) + 1/2 O2(g) → H2O(l) + 68 kcal
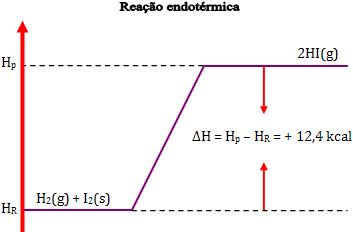
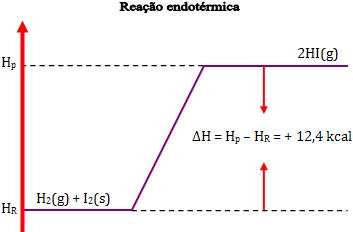
Na reação endotérmica, temos H2 maior que H1, de maneira que ∆H tem um valor positivo.
Exemplo:
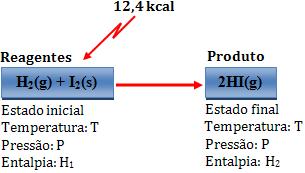
Variação de entalpia:
∆H = H2 – H1 = 12,4 kcal
Desse modo, dois mols de Hl gasoso possuem energia 12,4 kcal a mais que o sistema formado por 1 mol de H2 gasoso e 1 mol de I2 sólido.
Através dos valores imaginários, temos:
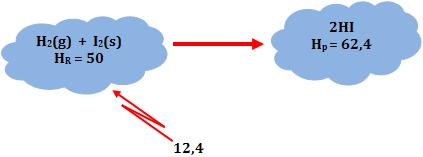
∆H = Hp – HR = 62,4 – 50 = 12,4
A equação pode ser escrita assim:
H2(g) + I2(s) → 2 HI(g) ∆H = + 12,4 kcal
Normalmente, o calor da reação seria um “reagente”.
H2(g) + I2(s) + 12,4 kcal → 2 HI(g)
ou
H2(g) + I2(s) → 2 HI(g) - 12,4 kcal
Lei de Hess ou da aditividade dos calores de reação
Quando a reação química ocorre em um ou diversos estágios, a variação de energia térmica nesse processo é constante, pois a variação de energia depende apenas das propriedades das substâncias nos estados inicial e final.
A Lei de Hess é bastante utilizada para determinar indiretamente calor de reação.
O total de calor liberado ou absorvido nas reações sucessivas: A → B e B → C é equivalente ao calor liberado ou absorvido na reação: A → C
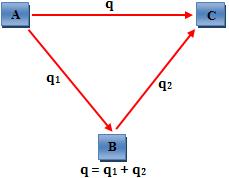
Analogamente, podemos dizer que:
“A variação de entalpia, ou seja, quantidade de calor liberada ou absorvida por um processo só depende do estado inicial e final do processo não dependendo das etapas intermediárias.”
A → B → D → C - calor completo – q1
A → B → C - calor completo – q2
A → C - calor completo – q3
q1 = q2 = q3
O calor liberado ou absorvido na reação A → C depende apenas do conteúdo energético de A e C
Cálculo do ∆H de uma reação, usando a lei de Hess. Podemos calcular o ∆H de uma reação trabalhando algebricamente as equações termoquímicas.
Exemplo:
Considere as reações abaixo, a 25°C e 1 atm.
1) C(grafita) + O2(g) → CO2(g) ∆H = - 94,1 kcal
2) H2(g) + 1/2 O2(g) → H2O (l) ∆H = - 68,3 kcal
3) CH4(g) + 2 O2(g) → CO2(g) + 2H2O (ι) →
→ ∆H = - 212,8 kcal
Vamos determinar o ∆H da reação:
C(grafita) + 2H2(g) → CH4(g) ∆H =
Siga os passos abaixo:
a) escreva a equação 1.
b) escreva a equação 2 multiplicada por 2.
c) escreva a equação inversa de 3.
O próximo passo é somá-las.
C(grafita) + O2(g) → CO2(g) ∆H = - 94,1 kcal
2H2(g) + O2(g) → 2H2O(l) ∆H = - 136,6 kcal
CO2(g) + 2H2O(l) → CH4(g) + 2O2(g)
∆H = + 212,8 kcal
C(grafita) + 2H2(g) → CH4(g) ∆H = - 17,9 kcal
Através da lei de Hess, as equações termoquímicas podem ser somadas como se fossem equações matemáticas ou algébricas.
Calor de combustão ou entalpia de combustão
É a variação de entalpia, ou seja, quantidade de calor liberada na combustão total de 1 mol de determinada substância, a 25°C e 1 atm de pressão.
Exemplos:
C2H6(g) + 7/2 O2(g) → 2 CO2(g) + 3 H2O(l)
∆H = -372,8 kcal
1H2(g) + 1/2 O2(g) → 1H2O(l)
∆H = – 68,56kcal/mol
CO(g) + 1/2 O2(g) → CO2(g)
∆H = – 67,7 kcal
Combustão de diamante e de grafita
C(grafita) + O2(g) → CO2(g)
∆H = - 94,059 kcal/mol
C(diamante) + O2(g) → CO2(g)
∆H = 94,512 kcal/mol
Em ambas as reações, o oxigênio e o gás carbônico estão nas mesmas circunstâncias. Desse modo, a diferença nas variações de entalpia na queima de diamante e grafita está relacionada com a diferença entre as suas energias.
C(diamante) → C(grafita) ∆H = - 0453 kcal/mol
Logo, a energia de 1 mol de grafita é menor que 1 mol de diamante.

Combustão de alimentos e combustíveis
Numa combustão de alimento ou combustível há liberação de energia.
Exemplo:
Queima de glicose
C6H12O6(s) + 6 O2(g) →
→ 6 CO2(g) + 6 H2O(l) + 15,6 kJ/g de glicose
Com relação ao impacto ambiental, qual o melhor combustível?
Todo combustível deve apresentar um alto poder calorífico além de produzir materiais que não poluam o meio ambiente.
A queima de combustível em motores irregulares produz um gás altamente tóxico, chamado monóxido de carbono (CO).
1 CH4 + 2 O2 → 1 CO2 + 2 H2O
1 CH4 + 1,5 O2 → 1 CO + 2H2O
A queima dos combustíveis fósseis, como carvão e petróleo, que possuem uma quantidade de enxofre em sua composição, produz o dióxido de enxofre (SO2) que é composto tóxico.
S + O2 → SO2
O SO2 é transformado em trióxido de enxofre SO3, que produz o ácido sulfúrico quando entra em contato com a água.
SO2 + 1/2 O2 → SO3
SO3 + H2O → H2SO4
Através da queima de combustíveis também são produzidos os óxidos de nitrogênio (NO2, N2O5) que em contato com a água produzem o ácido nítrico, constituindo, assim, a chuva ácida.
3 NO2 + H2O → 2 HNO3 + NO
O hidrogênio é considerado o combustível mais adequado para ser usado, quanto ao impacto ambiental, pois a sua queima só produz água, que não é uma substância poluente.
Com relação ao poder calorífico, qual o melhor combustível? Como já vimos no tópico anterior, todo combustível deve apresentar um alto poder calorífico.
Nesse sentido, o hidrogênio é o combustível mais adequado. A quantidade de calor liberada durante a combustão de um quilograma de hidrogênio é aproximadamente três vezes maior do que a quantidade liberada na combustão de um quilograma de gasolina com 20% de etanol.
Calor de neutralização
É a variação de entalpia, ou seja, quantidade de calor liberada verificada na neutralização total de hidrogênio ionizável (H+) por um mol de hidroxila dissociada admitindo-se todos os participantes em diluição total ou infinita (ponto de diluição total), a 25°C e 1atm.
Observações:
– Reação de neutralização é uma reação entre um ácido e uma base produzindo sal e água.
– Neutralização total é aquela cujo sal formado não apresenta na sua estrutura hidrogênio ionizável ou hidroxila dissociável.
– Toda vez que a neutralização for proveniente de um ácido forte ou uma base forte, o ∆H é praticamente constante e vale – 13,7kcal/mol ou – 57,7kJ/mol.
Exemplos:
HBr(aq) + NaOH(aq) →
→ NaBr(aq) + H2O(l) ∆H = - 13,76 kcal
HNO3(aq) + NaOH(aq) →
→ NaNO3(aq) + H2O(l) ∆H = 13,96 kcal
Onde:
aq = solução totalmente diluída.
Calor de formação
A entalpia H de um sistema não pode ser calculada experimentalmente, somente as diferenças ∆H. O calor de formação permitiu calcular a entalpia de várias sustâncias até então desconhecidas, a partir da variação de entalpia
Estado padrão na termoquímica é caracterizado por:
– Temperatura de 25°C
– Pressão de 1atm.
– Estrutura cristalina ou alotrópica mais estável (se for o caso).
– Estado físico usual da substância.
Por convenção, substância simples ou elemento químico no estado padrão possui entalpia sempre zero.
Calor de formação é a quantidade de calor liberada ou absorvida na síntese de 1 mol da substância a partir de seus elementos no estado padrão (forma alotrópica mais estável, a 25°C e 1atm).
Levando em conta a convenção citada acima, podemos concluir que a entalpia H de uma substância é equivalente ao calor de formação (∆Hf) dessa substância.
Exemplos:
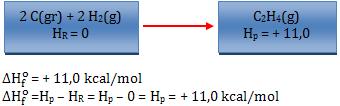
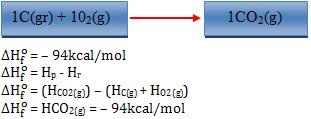
Observação:
- O sobrescrito “o” revela que a variação de entalpia foi medida nas condições padrão (25°C e 1 atm).
- O sinal (-) indica que o sistema perde.
- O sinal(+) indica que o sistema ganha.
Logo, quando o sinal for (-) significa que a síntese foi exotérmica, quando o sinal for (+) significa que a síntese foi endotérmica.
Cálculo do ∆H de uma reação, usando calor de formação.
Considere a reação do tipo:
A + B → C + D ∆H = ?
H1 H2 H3 H4
Tendo conhecimento das entalpias de cada substância através de uma tabela, podemos calcular o ∆H da reação:
∆H = Hp – HR
∆H = (H3 + H4) – (H1 + H2)
Exemplo:
Considere os calores de formação:
CH4 : ∆Hf = - 17,9 kcal/mol
CO2: ∆Hf = - 94,1 kcal/mol
H2O: ∆Hf = - 68,3 kcal/mol
Vamos calcular a variação de entalpia na seguinte reação:
CH4 + 2 O2 → CO2 + 2 H2O ∆H = ?
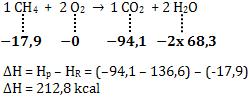
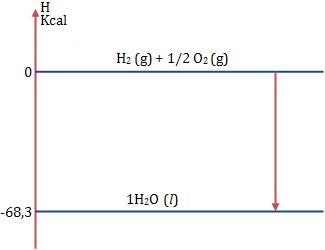
Diagrama de entalpia Segundo a Lei de Hess, a variação de entalpia, ou seja, quantidade de calor liberada ou absorvida por um processo só depende do estado inicial e final do processo não dependendo das etapas intermediárias.
Independente do caminho percorrido pelos dois estados, a variação de entalpia será a mesma.
Seja um sistema no qual o estado inicial será representado por A, e o estado final por D. Considere que existam dois caminhos, pelos quais podemos obter o estado final a partir do estado inicial.
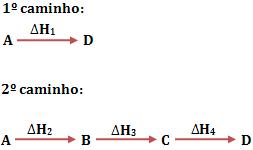
Veja abaixo a representação das entalpias dos vários estados por linhas horizontais:
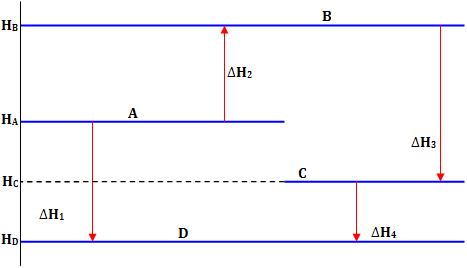
Logo, conforme a Lei de Hess, devemos ter:
HD – HA = ∆H1 = ∆H2 + ∆H3 + ∆H4
É por esta razão que a Lei de Hess é também conhecida como a lei da Atividade das Entalpias.
Dessa forma, é possível representar as variações de entalpia no formato de diagrama.
Exemplo:
Vamos representar 1 mol de H2O (l):
Energia de ligação ou energia de dissociação
É a variação de entalpia, ou seja, quantidade de calor absorvido na quebra de 1mol de determinada ligação, admitindo-se todos os participantes no estado gasoso, a 25°C e 1atm.
A energia necessária para quebrar 6,02 x 1023 ligações
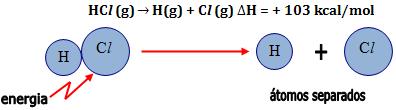
A energia para quebrar 1 mol de ligações O = O, produzindo átomos no estado gasoso, é 118 kcal.
No processo contrário, ou seja, quando átomos de oxigênio se ligam, formando 6,02 x 1023 ligações, são liberados 118 kcal.
Cálculo de ∆H de uma reação usando energia de ligação Exemplo
Seja a reação:
H2(g) + 1/2 O2(g) → H2O (g) ∆H = ?
Considere as energias de ligação:
No calculo do ∆H, consideraremos que todas as reações nos reagentes sejam quebradas, ou seja, a energia é absorvida, e que nos produtos, novas ligações sejam formadas, ou seja, a energia é liberada.
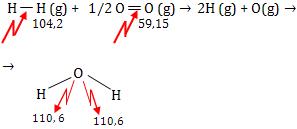

O balanço energético dá o ∆H:
∆H = + 163,35 kcal – 221,2 kcal = - 57,85 kcal
http://www.colegioweb.com.br/quimica/calculo-de-8710h-de-uma-reacao-usando-energia-de-ligacao.html

Nenhum comentário:
Postar um comentário