Definição
Isômeros são compostos que possuem fórmulas moleculares iguais, mas propriedades químicas diferentes, devido às fórmulas estruturais diferentes.
O fenômeno da isomeria, na Química, é semelhante ao fenômeno da existência de palavras diferentes pela permutação de letras, como por exemplo: AMOR e ROMA (mesmas letras, “iguais” fórmulas moleculares; diferentes arrumações, “diferentes” fórmulas estruturais).
1-2 – Classificação
A isomeria dividi-se em plana e espacial.
Vejamos:
• Isomeria Plana:
A isomeria plana ocorre quando os isômeros podem ser diferenciados através de suas fórmulas estruturais planas.
• Isomeria Espacial ou Estereoisomeria:
A isomeria espacial ocorre quando os isômeros podem ser diferenciados através de suas fórmulas estruturais espaciais.
A isomeria divide-se em isomeria plana e isomeria espacial.
ISOMERIA PLANA
Os isômeros apresentam mesma fórmula molecular, mas diferentes fórmulas planas.
Dividem-se em:
1. Isomeria de Cadeia
Os isômeros têm cadeias carbônicas diferentes.
Exemplos:
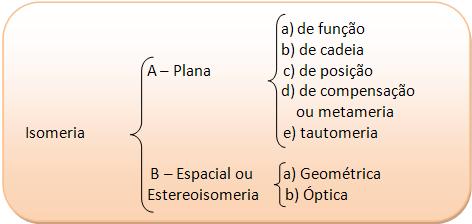
a) Cadeia aberta X Cadeia fechada:
b) Cadeia normal X Cadeia ramificada:
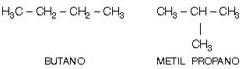
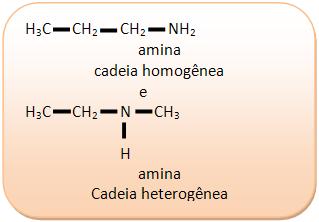
c) Cadeia homogênea X cadeia heterogênea:
2. Isomeria de Posição
Os isômeros têm a mesma cadeia carbônica, mas diferem pela posição de radicais, ligações duplas ou triplas.
Exemplos:
a) Diferente posição do radical:
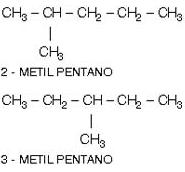
b) Diferente posição de um grupo funcional:
c) Diferente posição de uma insaturação:
Neste caso, é importante ter bastante atenção no exemplo. Observe:
HO – CH2 – CH2 – CH3
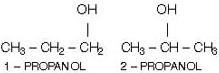
3 – Isomeria plana ou estrutural
Nesta isomeria existe uma diferença entre os isômeros e que pode ser notada no plano.
A diferença entre os isômeros etanol e éter dimetílico, está nos arranjos dos átomos, pois são diferentes nas duas moléculas.
Existem vários casos de isomeria plana ou estrutural.
4 – Isomeria de função ou funcionalOs isômeros pertencem a funções químicas diferentes.
Vejamos:
I) Aldeídos e cetonas
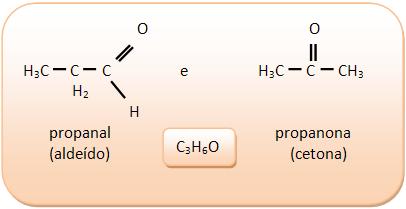
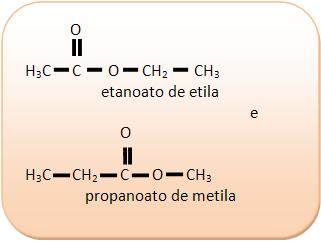
II) Ácidos carboxílicos e ésteres
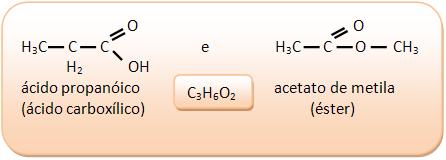
III) Álcoois e éteres
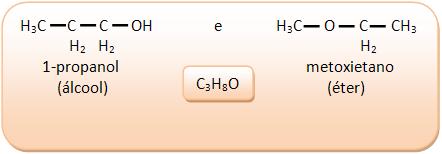
5 – Isometria de cadeia
Os isômeros possuem a mesma função química, contendo números diferentes de átomos de carbono na cadeia principal.
Vejamos:
I) C4H10
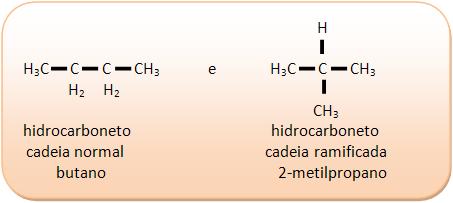
II) C3H6
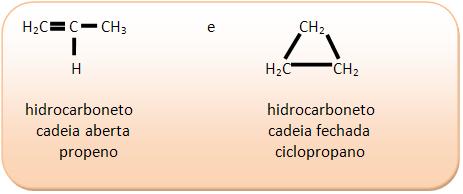
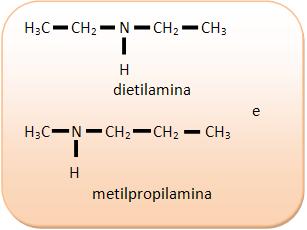
III) C3H9N
6 – Isomeria de posição
Os isômetros de posição possuem a mesma função e a mesma cadeia, porém apresentam diferenças na posição do substituinte de uma insauração, ou até mesmo de um grupo funcional.
I) C3H8O

II) C4H8
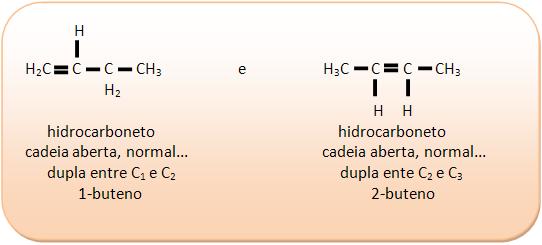
III) C6H6O2
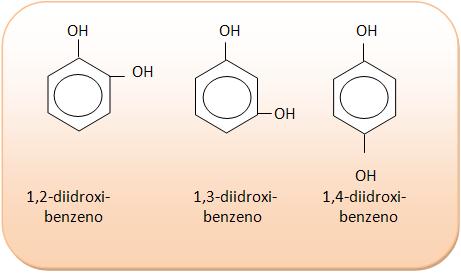
7 – Isometria de compensação ou metameria
Os isômeros fazem parte da mesma função, possuem a mesma cadeia, porém apresentam uma diferença na posição do heteroátomo.
É importante lembrarmos que qualquer função que possua cadeia heterogênea, pode apresentar esta isomeria.
I) C4H10O
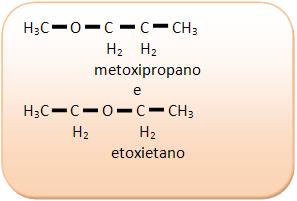
II) C4H11N
III) C4H8O2
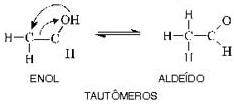
8 – TautomeriaÉ uma isomeria funcional onde dois ou até mais isômeros ficam simultaneamente em equilíbrio dinâmico na solução, transformando-se um no outro, através da mudança da posição do H na molécula.
A tautomeria ou isomeria dinâmica pode ser chamada também de cetoenólica ou aldoenólica, pois ela acontece nas cetonas e enóis ou aldeídos e enóis. O enol é um composto que possui hidroxila (–OH) ligada a um carbono com uma dupla ligação.
I) C2H4O
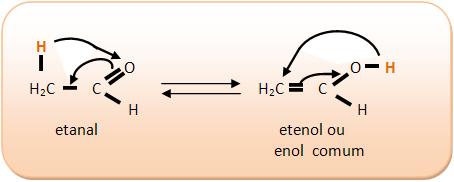
II) C3H6O
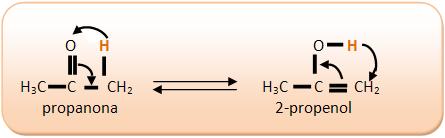
carbono do enol (en = dupla ligação; ol = álcool) “desloca-se” para o carbono (dizemos que o oxigênio sofreu uma “transposição”); simultaneamente, a dupla ligação que estava entre o primeiro e o segundo carbono se “desloca-se”, ficando agora entre o primeiro carbono e o oxigênio (dizemos que o composto todo sofreu um “rearranjo molecular”). No entanto a reação é reversível, isto é, o aldeído volta a transformar-se no enol inicial. Ora, sabemos que toda reação reversível tende para um equilíbrio dinâmico; é o que acontece com o par aldeído-enol mostrado antes, surgindo então o chamado equilíbrio aldo-enólico. Medidas feitas em laboratório mostram que, nesse equilíbrio, a maior porcentagem é sempre de aldeído, pois ele é o composto mais estável.
Cetona e enol
Como segundo exemplo, citamos o caso de equilíbrio entre uma cetona e um enol, que, na verdade, é totalmente idêntico ao caso anterior:
Isomeria Espacial
Os isômeros apresentam mesma fórmula molecular, mesma fórmula plana, mas diferentes fórmulas estruturais espaciais.
Divide-se em:
Isomeria Geométrica (ou Cis-Trans)
Em Compostos de Cadeia Acíclica com Dupla Ligação
Considere, com bastante atenção, os dois exemplos que serão dados a seguir:
1.° exemplo – Seja o composto ClCH2 – CH2Cl; podemos representá-lo pelo “modelo de bolas” das seguintes maneiras:

No entanto as três representações indicam a mesma coisa, pois trata-se da mesma estrutura espacial, isto é, do mesmo composto; de fato , a ligação simples entre os dois carbonos pode girar livremente; desse modo, basta “rodar” o carbono superior da estrutura “B” 120° para que ela coincida com a estrutura “A”; bem como “rodando” o carbono superior da estrutura “C” 120°, ela coincide com “B”, e continuando o “giro” por mais 120°, ela coincide com “A” . Enfim, sempre que houver superposição das figuras, elas estarão representando o mesmo composto.
2.° exemplo – Seja o composto ClCH = CHCl; usando-se o “modelo de bolas”, podemos ter as seguintes “arrumações” espaciais:
Repare no seguinte:
· Na primeira figura, os dois átomos de cloro estão do “mesmo lado” do plano que “divide” a molécula ao meio; esta é a chamada forma CIS (cis = mesmo lado).
· Na segunda figura, os dois átomos de cloro estão de “lados opostos” do plano que “divide” a molécula ao meio; esta é a chamada forma TRANS (trans = através ou transversal) .
Isomeria Óptica
Os compostos que possuem mesma fórmula molecular, porém diferentes atividades ópticas são chamados de isômeros ópticos.
Atividade Óptica
Observe a figura abaixo:
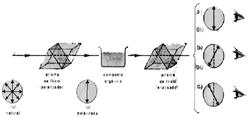
Quando a luz prolongada (após passar pelo prisma de Nicol - polarizador) atravessa o composto orgânico em análise, observamos os seguintes resultados:
No caso “a”, a luz polarizada que vibrava num determinado plano, ao atravessar o composto orgânico, continuou vibrando no mesmo plano. Dizemos, então, que o composto em questão não tem atividade sobre a luz; ele é opticamente inativo.
No caso “b” , a luz polarizada, após atravessar o composto orgânico, passou a vibrar em um plano à direita daquele em que vibrava anteriormente. Portanto o composto é opticamente ativo. Por ter girado o plano da luz polarizada para a direita, dizemos que é dextrógiro.
No caso “c”, após atravessar o composto orgânico, a luz polarizada passou a vibrar num plano à esquerda do original. Concluímos que o composto é opticamente ativo. Por ter girado o plano de vibração da luz polarizada para a esquerda, dizemos que é levógiro.
A atividade óptica de um composto está relacionada diretamente com a assimetria de suas moléculas.
Molécula assimétrica é a que nunca se consegue dividir de modo que os dois lados resultantes dessa divisão fiquem iguais. Essa assimetria molecular pode ser expressa de dois modos: presença de carbono assimétrico e assimetria molecular propriamente dita (sem carbono assimétrico).
Isomeria Óptica com Carbono Assimétrico
Carbono assimétrico (ou quiral) é aquele que possui quatro ligantes, todos diferentes entre si.
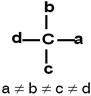
Um exemplo comum é o ácido láctico (ou ácido 2 - hidroxi - propanóico), que é proveniente do leite.
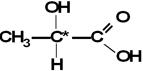
Ácido 2-hidroxi-propanóico ou ácido lático
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário