Essa isomeria possui uma diferença entre os isômeros, porém essa diferença só é percebida através da fórmula espacial dos compostos.
Existem dois casos principais:
a) Isomeria geométrica
b) Isomeria óptica
2 – Isomeria geométrica ou cis-trans
Ocorre em compostos de cadeia cíclica e em compostos de cadeia acíclica.
3 – Isomeria geométrica em compostos de cadeia aberta
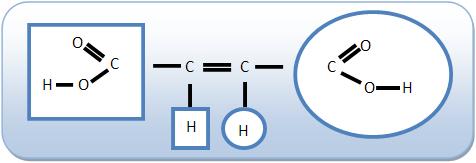
Os compostos apresentam ao menos uma dupla ligação entre os átomos de carbono e dois ligantes diferentes em cada carbono de dupla.
Vejamos:
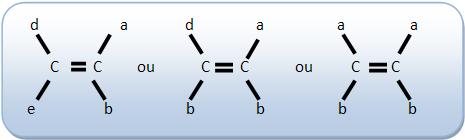
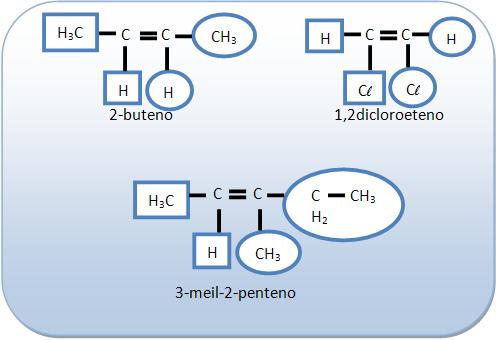
Possuem isomeria geométrica:
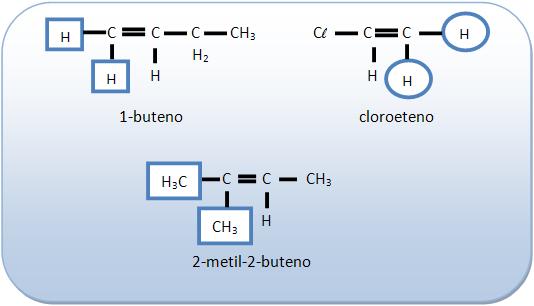
Não possuem isomeria geométrica:
4 – Os átomos de carbono não giram ao redor da ligação dupla
Os átomos de carbono são unidos através de ligações simples, vejamos:
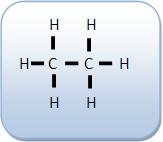
Torna-se possível girar um átomo de carbono em relação ao outro em volta da ligação simples, sem que haja rompimento de ligações.
Os átomos de carbono do eteno estão unidos através de uma ligação dupla:
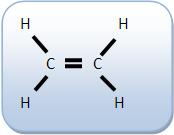
Torna-se impossível girar os átomos de carbono em volta da ligação dupla. Esta impossibilidade de rotação provoca a isomeria geométrica. No caso do eteno os átomos estão no mesmo plano.
Os átomos de carbono são unidos através de ligações simples, vejamos:

Torna-se possível girar um átomo de carbono em relação ao outro em volta da ligação simples, sem que haja rompimento de ligações.
Os átomos de carbono do eteno estão unidos através de uma ligação dupla:

Torna-se impossível girar os átomos de carbono em volta da ligação dupla. Esta impossibilidade de rotação provoca a isomeria geométrica. No caso do eteno os átomos estão no mesmo plano.
5 – Isômero cis (vizinhos, mesmo lado) ou isômero Z (inicial da palavra alemça zusammen = “juntos”
Os espaços mostram grupos de grandes massas molares do mesmo lado do plano dado pela dupla ligação.
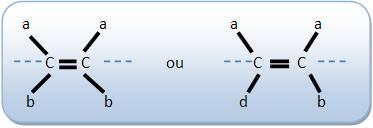
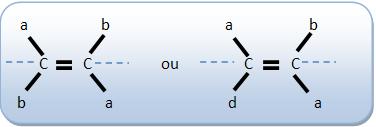
6 – Isômero trans (através, transversal ou isômero E (inicial da palavra alemã entgegen = “opostos”)
Os espaços mostram grupos de maior massa molar em lados opostos do plano estabelecido pela dupla ligação.
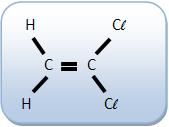
O 1,1-dicloroeteno não apresenta isomeria geométrica.
O prefixo cis ou a letra Z serão utilizados quando os grupos de maior massa molar estiverem do mesmo lado.
O prefixo trans ou a letra E serão utilizados quando os grupos de maior massa molar estiverem de lados opostos.
7 – Os isômeros cis e trans têm propriedades diferentes.
Os ácidos butenodióicos:
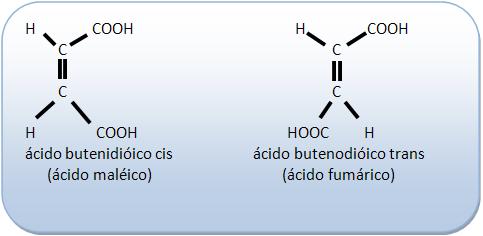
Os isômeros cis-trans, apresentam diferenças entre si através de suas propriedades físicas (ponto de ebulição, ponto de fusão, densidade, solubilidade).
Ácido butenodióico cis | Ácido butenodiódico trans | |
P.F. | 130° | 287°C |
Densidade | 1,590g/cm3 | 1,635g/cm3 |
Solubilidade em H2O | solúvel | menos solúvel |
As propriedades químicas, os isômeros geométricos podem apresentar ou não diferenças.
O ácido maléico se aquecido vira o anidrido.
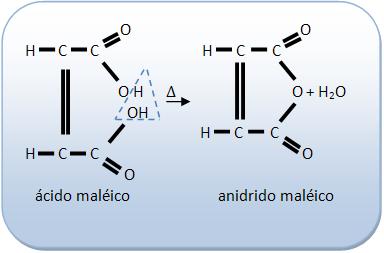
O ácido fumárico quando aquecido, não oferece anidrido, por aquecimento brando, não sofre desidratação. O ácido fumário consegue oferecer o anidrido maléico quando sofre aquecimento enérgico.
8 – Isomeria geométrica em compostos de cadeia fechada
O composto deve apresentar pelo menos dois átomos de carbono do ciclo com dois ligantes diferentes.
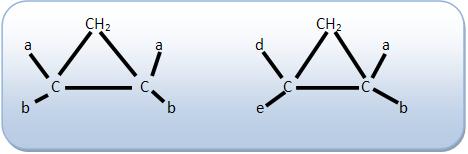
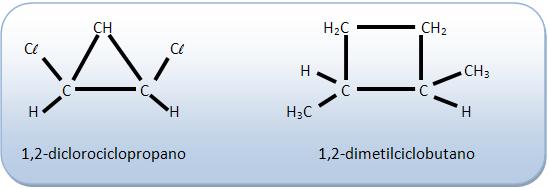
Não possuem isomeria geométrica:
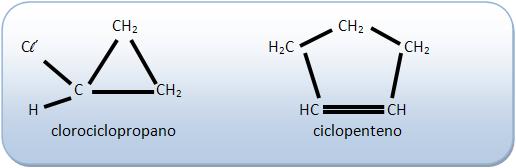
Nos compostos cíclicos o plano de referência é o próprio plano do ciclo.
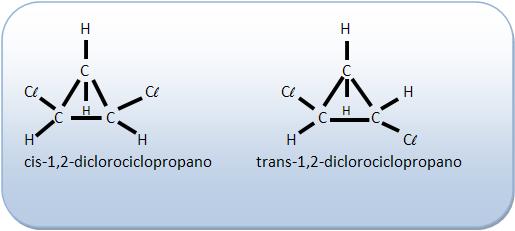
Em homenagem ao químico alemão Adolf Von Baeyer a isomeria geométrica de compostos cíclicos também é muito conhecida como isomeria Baeyeriana, uma homenagem ao químico alemão Adolf Von Baeyer.
http://www.colegioweb.com.br/quimica

Nenhum comentário:
Postar um comentário