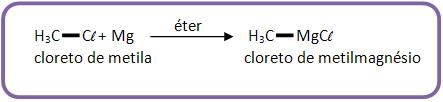
O composto de Grignard recebe este nome em homenagem ao químico francês Victor Grignard. Trata-se de um composto organometálico de fórmula R – Mg X onde o X pode ser um halogênio qualquer).
Vejamos alguns exemplos:
H3C – MgI: iodeto de metilmagnésio
H3C – CH2 – MgBr: brometo de etilmagnésio
O composto de Grignard se dá através da reação de derivados de halogenado junto com magnésio em meio estéreo (o composto de Grignard reage com água).
Vejamos um exemplo:
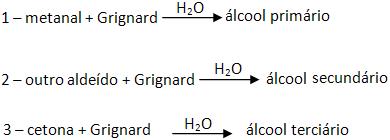
2 – Com metanal (aldeído fórmico, formaldeído)
Reações que formam álcool primário.
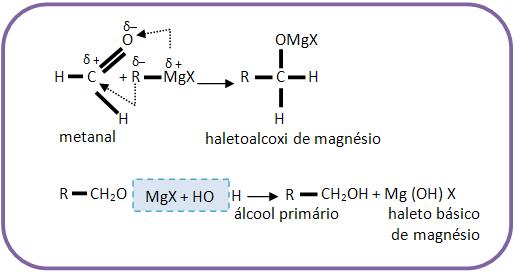
Se for pra se obter o etanol, devemos reagir metanal junto com cloreto de metilmagnésio e depois com hidrólise.
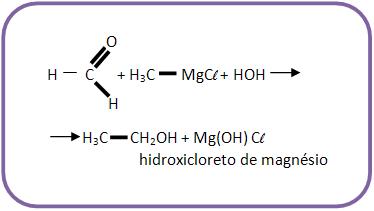
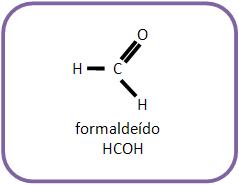
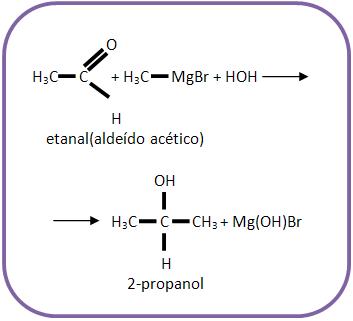
3 – Com aldeído que não seja o metanal
Reações que formam álcool secundário.
Vejamos um exemplo:
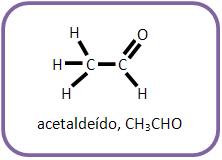
Para se ter 2-propanol, deve-se reagir etanal junto com brometo de metilmagnésio e depois com hidrólise.
Reações que formam álcool secundário.
Vejamos um exemplo:
Para se ter 2-propanol, deve-se reagir etanal junto com brometo de metilmagnésio e depois com hidrólise.


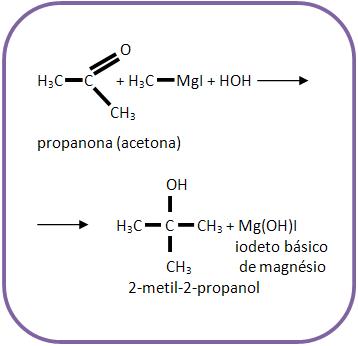
4 – Com cetona
Reações que formam álcool terciário.
Vejamos um exemplo:
Para obter o metil-2-propanol, deve-se reagir propanona com iodeto de metilmagnésio e depois com hidrólise.
Resumo:
5 – Com éster
Reações que formam cetona, que reage com o composto de Grignard formando o álcool terciário.
Reações que formam cetona, que reage com o composto de Grignard formando o álcool terciário.
6 – Com dióxido de carbono (CO2)
Processos para obtenção de ácido carboxílico.
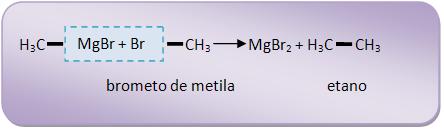
7 – Com derivado halogenado
Formação de hidrocarboneto.
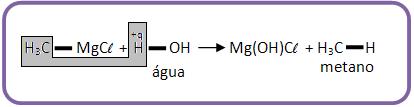
8 – Com água
Os compostos apresentam hidrogênio são bem polarizados, os compostos de Grignard reagem formando hidrocarboneto.
Exemplo:
Os compostos apresentam hidrogênio são bem polarizados, os compostos de Grignard reagem formando hidrocarboneto.
Exemplo:

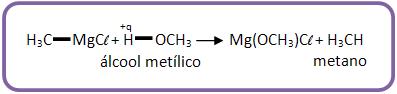
9 – Com álcool
Na reação obtém-se hidrocarboneto.
Exemplo:
10 – Reações com sódio metálico
Vários compostos orgânicos são capazes de reagir com o sódio, onde algumas dessas reações são consideradas processos de obtenção de substâncias orgânicas, já outras são usadas para o processo de diferenciação de muitas funções orgânicas. É importante sabermos que essas reações são também de oxidorredução.
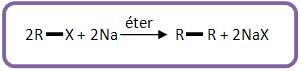
11 – síntese de Wurtz
É a obtenção dos alcanos.
Baseado na reação de haletos de alquila com sódio metálico, em meio etérico:
Vejamos:
Utilizando a síntese de Wurtz para obter butano:
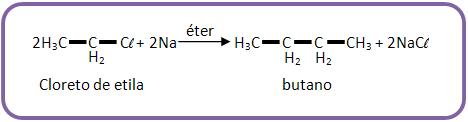
Podendo usar também o iodeto de etila ou o brometo de etila.
12 – Alcinos verdadeiros com sódio
Para identificar os alcinos verdadeiros dos falsos, usa-se a reação de alcino com sódio, pois os alcinos verdadeiros reagem com sódio, já os falos não. Os verdadeiros apresentam reações de adição e substituição.
Com a fórmula C4H6, apresentam-se dois alcinos diferentes na reação:
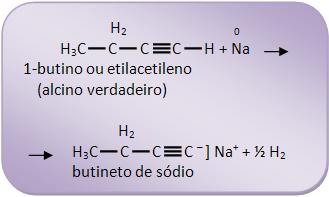
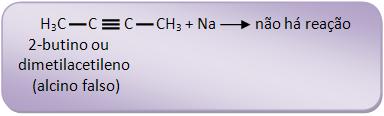
O propino é considerado alcino verdadeiro, pois reage com sódio:
Vejamos:
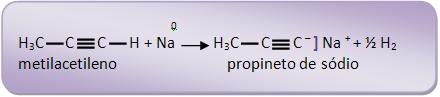
O etino junto com os metais alcalinos pode formar acetileto, pela saída de um ou de dois hidrogênios.
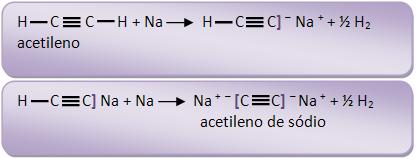
13 – Álcoois com sódio
Os metais alcalinos e alcalinoterrosos deslocam o H dos álcoois, formando alcóxi ou alcóxidos de metais.
A reação é bem parecida com a que acontece com a água, porém é mais suave, pois a água reage com o Na violentamente, já o álcool reage com o metal suavemente.
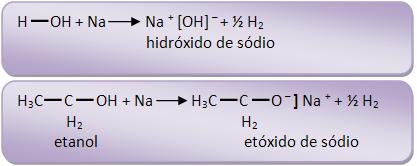
Durante o processo a reação permite diferenciar éteres e álcoois isômeros, pelo fato de um éter isômero não reagir com sódio.

Os metais alcalinos e alcalinoterrosos deslocam o H dos álcoois, formando alcóxi ou alcóxidos de metais.
A reação é bem parecida com a que acontece com a água, porém é mais suave, pois a água reage com o Na violentamente, já o álcool reage com o metal suavemente.

Durante o processo a reação permite diferenciar éteres e álcoois isômeros, pelo fato de um éter isômero não reagir com sódio.
14 – Fenóis com sódio
Os fenóis com sódio reagem da mesma forma que os álcoois.
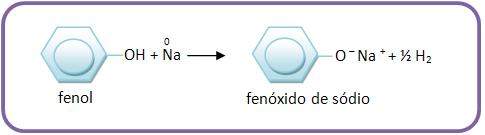
Os fenóis com sódio reagem da mesma forma que os álcoois.

15 – Ácidos carboxílicos com sódio
Os ácidos carboxílicos com sódio reagem produzindo sais de ácido.
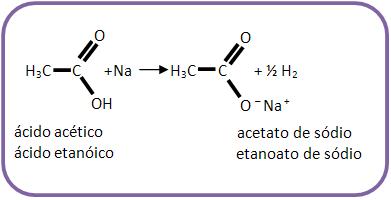
Os ácidos carboxílicos com sódio reagem produzindo sais de ácido.

16 – Reações com sais de ácido carboxílico
Método de Dumas
O método de Dumas é considerado um processo de obtenção de hidrocarbonetos, que resume-se no aquecimento a seco de sal de sódio de ácido carboxílico com cal sodada (mistura de NaOH e CaO).
Método de Píria
O método de Píria resume-se no aquecimento a seco de sal de cálcio ou bário de ácido carboxílico, para obter a cetona.
Síntese de Kolbe
Essa síntese é considerada um processo de obtenção dos alcanos, realizando a eletrólise de solução aquosa dos sais de sódio de ácido carboxílico.
Método de Dumas
O método de Dumas é considerado um processo de obtenção de hidrocarbonetos, que resume-se no aquecimento a seco de sal de sódio de ácido carboxílico com cal sodada (mistura de NaOH e CaO).
Método de Píria
O método de Píria resume-se no aquecimento a seco de sal de cálcio ou bário de ácido carboxílico, para obter a cetona.
Síntese de Kolbe
Essa síntese é considerada um processo de obtenção dos alcanos, realizando a eletrólise de solução aquosa dos sais de sódio de ácido carboxílico.
17 – Reação de aminas com ácido nitroso
A reação de aminas com ácido nitroso é um processo que mostra as diferenças das aminas primárias, das secundárias e das terciárias.
18 – Amina primária + ácido nitroso (HNO2)
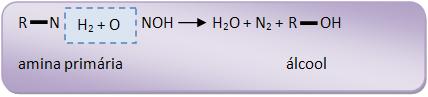
As aminas primárias alifáticas irá reagir com HNO2, formando álcoois (não necessariamente primários).
20 – Amina terciária + ácido nitroso
Não irá ocorrer liberação de gás N2, nem formação de precipitado, pelo fato das aminas terciárias alifáticas não reagirem com HNO2.
22 – Determinação da equação de uma reação orgânica
A variação dos números de reações que seguem mecanismos clássicos e particulares entre os compostos orgânicos é muito grande.
Em exercícios pode-se pedir o conhecimento de todas essas reações de cor, mas costuma-se fornecer apenas o modelo da reação e tendo como base o modelo, pede-se o equacionamento da reação para uma espécie em particular.
É dada a equação faltando um reagente ou produto. Com base na lei de conservação dos átomos, a substância que falta pode ser determinada.
A reação química pode ser dada no enunciado da questão na forma de texto, usando palavras. É só escrever a equação usando as fórmulas das substâncias que estão envolvidas.
Podemos analisar essas situações nos exemplo:
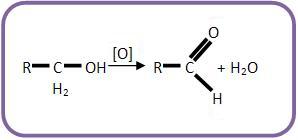
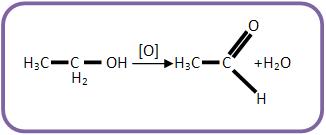
I) Álcool primário pode se transformar em aldeído através do processo de oxidação branda:
“Álcool etílico ingerido pelo ser humano é transformado pelo fígado em aldeído acético, uma das substâncias responsáveis pelas dores de cabeça chamadas de ‘ressacas’.”
Escreva a equação e o nome do produto formado na reação citada no texto.
Resolução
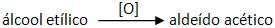
II) Forma-se o inseticida DDT através do aquecimento de clorobenzeno e tricloroetanal (cloral) na presença de ácido sulfúrico:
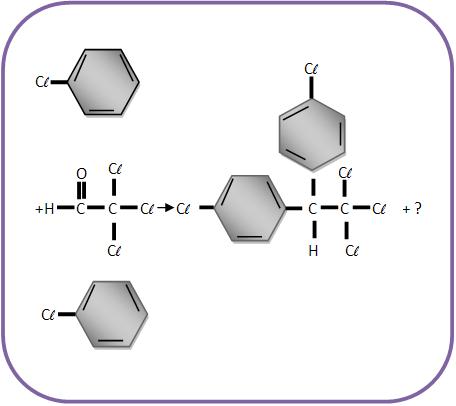
Qual o termo que falta para completar a equação?
Resolução
Veja que o 1° membro há um átomo de oxigênio. Então no termo desconhecido deve haver um átomo de oxigênio. No 1° membro existem 11 átomos de H, enquanto no 2° membro aparecem apenas 9 átomos de H. Os outros átomos estão balanceados. Portanto o termo que faltava para completar a equação é H2O.
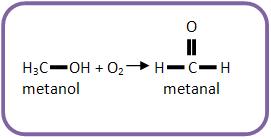
III) (UNICAMP-SP) O metanol é uma alternativa como combustível para veículos automotores.
Na sua combustão incompleta com oxigênio pode-se formar metanal (aldeído fórmico). Escreva a equação química (balanceada) que representa essa reação.
Resolução
Escreva as fórmulas das substâncias envolvidas de acordo com o texto:
Agora balanceie o carbono:
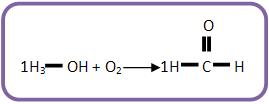
Veja que sobraram H e O no 1° membro. Portanto, deve-se formar água.
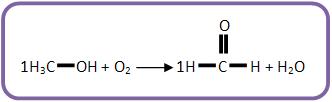
Agora balanceie a equação:
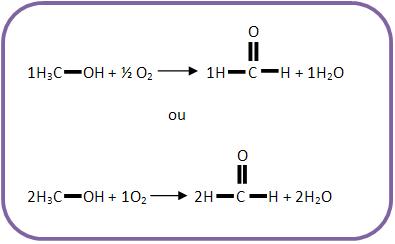
23 – Metano
Ocorrência
a) Gás natural
b) Exalação dos pântanos que se forma com a fermentação de anaeróbica da celulose, sob a ação de microorganismos.
(C6H10O5)n + n H2O → 3n(CH4) + 3n (CO2)
c) Minas de carvão, onde forma-se a mistura explosiva chamada gás grisu. A lâmpada de Davy, também conhecida como a lâmpada dos mineiros, é um dispositivo de segurança que possui uma pequena chama envolvida por uma tela metálica. Se a chama se apagar, é sinal de perigo.
Obtenção
O metano pode ser obtido através do gás natural, do gás de iluminação (ou gás de rua), de materiais de esgoto.
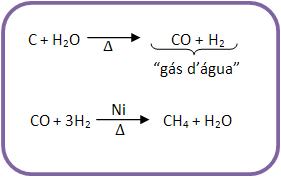
a) Sabatier-Senderens
Sabatier-Senderens é o tratamento do “gás d’água” por hidrogênio, em presença de níquel (catalisador) a 300°C.
O “gás d’água” é considerado uma mistura de CO e H2, preparada pela reação de carvão incandescente e vapor d’água.
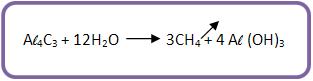
b) Método de Moissan
O método de Moissan é a hidrólise do carboneto de alumínio:
c) Método de Dumas
O método de Dumas é considerado o aquecimento a seco de acetato de sódio (sal orgânico) com cal sodada (mistura de CaO + NaOH).
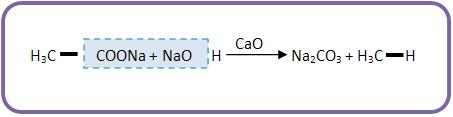
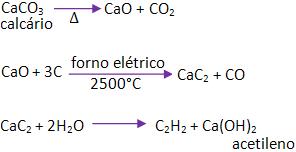
24 – Acetileno (etino)
Obtenção – processo de Moissan
Forma-se na hidrólise do carboneto de cálcio (carbureto de cálcio).

Obtem-se o acetileno (etino) na indústria, através das matérias- primas encontradas em na natureza, como por exemplo: calcário, carvão e água.
Aplicações do acetileno
O acetileno pode ser aplicado como gás combustível, usado nos maçaricos oxiacetilênicos, empregados em soldas autogênicas.
C2H2 + 5/2 O2 → 2CO2 + H2O + calor
A chama do maçarico chega a atingir 3000°C.

O acetileno também pode ser empregado na obtenção de polímeros e um grande número de compostos orgânicos.
http://www.colegioweb.com.br/quimica

As aminas primárias alifáticas irá reagir com HNO2, formando álcoois (não necessariamente primários).
19 – Amina secundária + ácido nitroso
As aminas secundárias alifáticas e as aminas secundárias aromáticas, para formar um precipitado de cor amarela (nitrosima), irão reagir com HNO2.
Essa nitrosima é considerada um agente que pode causar câncer em seres humanos.
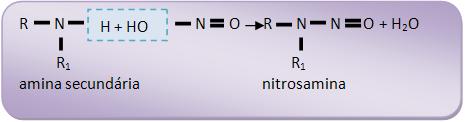
As aminas secundárias alifáticas e as aminas secundárias aromáticas, para formar um precipitado de cor amarela (nitrosima), irão reagir com HNO2.
Essa nitrosima é considerada um agente que pode causar câncer em seres humanos.

20 – Amina terciária + ácido nitroso
Não irá ocorrer liberação de gás N2, nem formação de precipitado, pelo fato das aminas terciárias alifáticas não reagirem com HNO2.

21 – Reação da uréia com ácido nitroso
A uréia pode ser considerada uma diamida do ácido carboxílico, ela é um sólido “suave” e solúvel em água, um produto do metabolismo das proteínas, usada como fertilizantes na fabricação de plásticos e resinas e na preparação do ácido barbitúrico.
Ela reage junto com o ácido nitroso liberando tanto gás nitrogênio como gás carbônico.
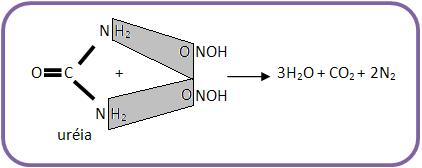
A uréia pode ser considerada uma diamida do ácido carboxílico, ela é um sólido “suave” e solúvel em água, um produto do metabolismo das proteínas, usada como fertilizantes na fabricação de plásticos e resinas e na preparação do ácido barbitúrico.
Ela reage junto com o ácido nitroso liberando tanto gás nitrogênio como gás carbônico.

22 – Determinação da equação de uma reação orgânica
A variação dos números de reações que seguem mecanismos clássicos e particulares entre os compostos orgânicos é muito grande.
Em exercícios pode-se pedir o conhecimento de todas essas reações de cor, mas costuma-se fornecer apenas o modelo da reação e tendo como base o modelo, pede-se o equacionamento da reação para uma espécie em particular.
É dada a equação faltando um reagente ou produto. Com base na lei de conservação dos átomos, a substância que falta pode ser determinada.
A reação química pode ser dada no enunciado da questão na forma de texto, usando palavras. É só escrever a equação usando as fórmulas das substâncias que estão envolvidas.
Podemos analisar essas situações nos exemplo:
I) Álcool primário pode se transformar em aldeído através do processo de oxidação branda:

“Álcool etílico ingerido pelo ser humano é transformado pelo fígado em aldeído acético, uma das substâncias responsáveis pelas dores de cabeça chamadas de ‘ressacas’.”
Escreva a equação e o nome do produto formado na reação citada no texto.
Resolução

II) Forma-se o inseticida DDT através do aquecimento de clorobenzeno e tricloroetanal (cloral) na presença de ácido sulfúrico:

Qual o termo que falta para completar a equação?
Resolução
Veja que o 1° membro há um átomo de oxigênio. Então no termo desconhecido deve haver um átomo de oxigênio. No 1° membro existem 11 átomos de H, enquanto no 2° membro aparecem apenas 9 átomos de H. Os outros átomos estão balanceados. Portanto o termo que faltava para completar a equação é H2O.
III) (UNICAMP-SP) O metanol é uma alternativa como combustível para veículos automotores.
Na sua combustão incompleta com oxigênio pode-se formar metanal (aldeído fórmico). Escreva a equação química (balanceada) que representa essa reação.
Resolução
Escreva as fórmulas das substâncias envolvidas de acordo com o texto:

Agora balanceie o carbono:

Veja que sobraram H e O no 1° membro. Portanto, deve-se formar água.

Agora balanceie a equação:

23 – Metano
Ocorrência
a) Gás natural
b) Exalação dos pântanos que se forma com a fermentação de anaeróbica da celulose, sob a ação de microorganismos.
(C6H10O5)n + n H2O → 3n(CH4) + 3n (CO2)
c) Minas de carvão, onde forma-se a mistura explosiva chamada gás grisu. A lâmpada de Davy, também conhecida como a lâmpada dos mineiros, é um dispositivo de segurança que possui uma pequena chama envolvida por uma tela metálica. Se a chama se apagar, é sinal de perigo.
Obtenção
O metano pode ser obtido através do gás natural, do gás de iluminação (ou gás de rua), de materiais de esgoto.
a) Sabatier-Senderens
Sabatier-Senderens é o tratamento do “gás d’água” por hidrogênio, em presença de níquel (catalisador) a 300°C.
O “gás d’água” é considerado uma mistura de CO e H2, preparada pela reação de carvão incandescente e vapor d’água.

b) Método de Moissan
O método de Moissan é a hidrólise do carboneto de alumínio:

c) Método de Dumas
O método de Dumas é considerado o aquecimento a seco de acetato de sódio (sal orgânico) com cal sodada (mistura de CaO + NaOH).

24 – Acetileno (etino)
Obtenção – processo de Moissan
Forma-se na hidrólise do carboneto de cálcio (carbureto de cálcio).
Obtem-se o acetileno (etino) na indústria, através das matérias- primas encontradas em na natureza, como por exemplo: calcário, carvão e água.

Aplicações do acetileno
O acetileno pode ser aplicado como gás combustível, usado nos maçaricos oxiacetilênicos, empregados em soldas autogênicas.
C2H2 + 5/2 O2 → 2CO2 + H2O + calor
A chama do maçarico chega a atingir 3000°C.

O acetileno também pode ser empregado na obtenção de polímeros e um grande número de compostos orgânicos.
http://www.colegioweb.com.br/quimica

Resumo muuuuito bom!! É muito difícil encontrar explicações desses assuntos na internet, principalmente a parte relacionada às reações com os compostos de Grignard.
ResponderExcluirMuito obrigada, Metaleiro :D
pô cara, o conteúdo ta bom. Porém tive algumas dificuldades na leitura com a escolha das cores da fonte.
ResponderExcluirEstou satisfeito por encontrar a solucao da minha questao "Compostos de Grignard"
ResponderExcluir