1- Bioquímica é a ciência que estuda os processos químicos que ocorrem nos organismos vivos. Trata da estrutura e função metabólica de componentes celulares como proteínas, carboidratos, lipídios, ácidos nucléicos e outras biomoléculas.
Dentre os diversos tipos de biomoléculas, muitas são moléculas grandes e complexas (polímeros), formadas pela reunião de unidades fundamentais (monômeros) repetidamente que dão origem a longas cadeias. Cada tipo de biomolécula polimérica apresenta unidades fundamentais diferentes. Por exemplo, as proteínas são polímeros cujas unidades monoméricas são os aminoácidos, enquanto que os ácidos nucléicos (como o DNA) são polímeros compostos por cadeias de nucleotídeos.
A bioquímica estuda as propriedades de moléculas biológicas importantes, como as proteínas e os ácidos nucléicos, e em particular a química de reações catalisadas por enzimas, através de diversas áreas de estudo como do código genético, da síntese de proteínas, do transporte de membrana celular e transdução de sinal.]
Como todas as formas de vida existentes hoje descendem do mesmo ancestral comum, elas apresentam em geral processos químicos parecidos.
2 – LípidesLípides (lipídeos) são todos os ésteres que são “formados” pelos organismos vivos, onde através da hidrólise forma ácidos graxos ao lado de outros compostos.
3 – Características dos lípides
A) Brancos ou levemente amarelados.
B) Gorduroso ao tato.
C) Pouco consistentes, podendo ser líquidos.
D) Sobre o papel, deixam uma mancha translúcida que não desaparece por aquecimento.
E) Insolúveis na água.
4 – Classificação dos lípides
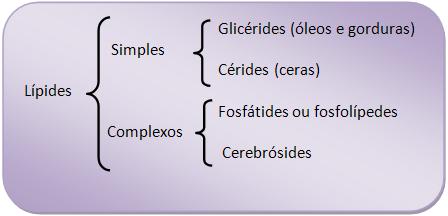

5 – Glicérides (glicéridos, glicerídios)
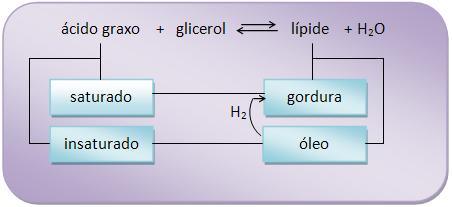
São ésteres de glicerol com ácidos graxos. Os óleos e gorduras animais e vegetais são misturas de glicérides (os óleos minerais não são glicérides).
Os ácidos graxos são ácidos carboxílicos de cadeia longa, mais freqüentes na constituição dos glicérides dos óleos e gorduras são:
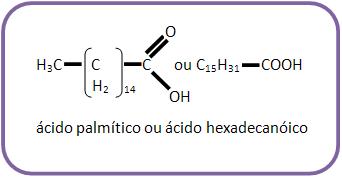
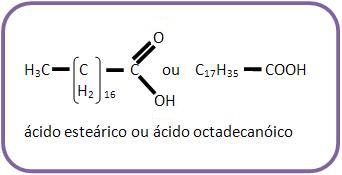

Observe que a fórmula molecular:
ácido graxo saturado é: CnH2n+1COOH.
Exemplos:
• ácido palmítico: C15H31COOH
• ácido esteárico: C17H35COOH
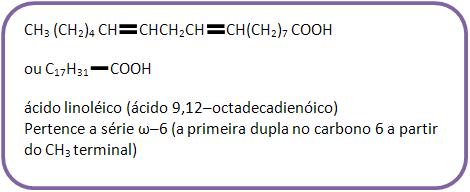
Se o ácido possui uma dupla ligação, o número de átomos de hidrogênio diminui duas unidades.
• ácido oléico: C17H33COOH
Para cada dupla ligação que aparece no ácido, número de átomos H diminui das unidades.
• ácido linoléico: C17H31COOH
• ácido linolênico: C17H29COOH
A glicerina ou glicerol é 1,2,3-propanotriol:
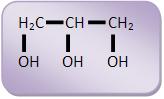
A glicerina ou glicerol é um líquido incolor, viscoso, inodoro, adocicado e higroscópico, seu nome oficial pela IUPAC é propano-1,2,3-triol . O seu ponto de ebulição é 290°C e a sua densidade é 1,261 g/mL a 20°C.
São ésteres de glicerol com ácidos graxos. Os óleos e gorduras animais e vegetais são misturas de glicérides (os óleos minerais não são glicérides).
Os ácidos graxos são ácidos carboxílicos de cadeia longa, mais freqüentes na constituição dos glicérides dos óleos e gorduras são:




Observe que a fórmula molecular:
ácido graxo saturado é: CnH2n+1COOH.
Exemplos:
• ácido palmítico: C15H31COOH
• ácido esteárico: C17H35COOH
Se o ácido possui uma dupla ligação, o número de átomos de hidrogênio diminui duas unidades.
• ácido oléico: C17H33COOH
Para cada dupla ligação que aparece no ácido, número de átomos H diminui das unidades.
• ácido linoléico: C17H31COOH
• ácido linolênico: C17H29COOH
A glicerina ou glicerol é 1,2,3-propanotriol:

A glicerina ou glicerol é um líquido incolor, viscoso, inodoro, adocicado e higroscópico, seu nome oficial pela IUPAC é propano-1,2,3-triol . O seu ponto de ebulição é 290°C e a sua densidade é 1,261 g/mL a 20°C.
6 – Óleos e gordurasCom relação à temperatura ambiente, o óleo é líquido e a gordura é sólida, onde nas gorduras prevalecem os glicérides de ácidos saturados e nos óleos os glicérides de ácidos insaturados.
7 – Principais óleos e gorduras
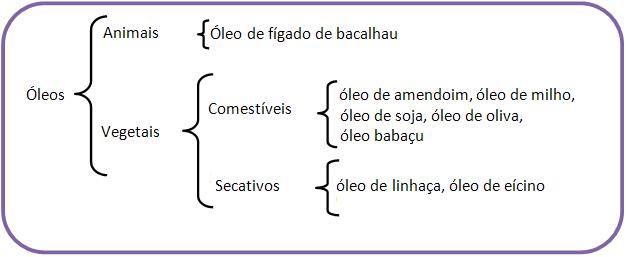

8 – Propriedades dos óleos e gorduras
A) Hidrólise e saponificação
A formação de uma triglicéride é uma reação de esterificação, podendo se tornar reversível.
A hidrólise sendo feita no meio ácido de uma gordura ou de um óleo, forma-se o glicerol e uma mistura de ácidos carboxílicos, podendo assim ser separados por destilação fracionada.
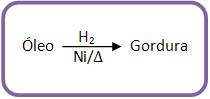
B) Transformação de óleo em gordura
Com a hidrogenação do óleo na presença de níquel a 150° C, todos os glicéridos insaturados ficam saturados, tornando-se sólido, ou seja, o óleo é transformado em gordura.
Observação: se os óleos vegetais forem hidrogenados, irá obter a margarina.
C) Rancificação de óleos e gorduras
Rancificação é considerada uma transformação química complexa, formada de hidrólises e oxidações. Dentro do processo químico, obtem-se compostos que deixam o produto com cheiros desagradáveis.
9 – Índice de saponificação
Esse índice é considerado a massa de KOH, dado em miligrama, que é necessária para que ocorra a saponificação de um grama de óleo ou gordura.
10 – Índice de iodo
Índice de iodo é a massa do iodo em gramas que é adicionada por 100g de glicéride.
11 – Cérides (ceras, cerídios)
Os cérides são considerados misturas de alcoóis superiores, ou seja, de cadeia carbônica grande com ésteres de ácidos graxos.

12 – Hidratos de carbono (carboidratos, açúcares, glúcides, glicídios)
Os hidratos de carbono são considerados compostos de função mista poliálcool-aldeído ou poliálcool-cetona, formando os referidos compostos de função mista.
Fórmula geral:
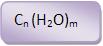
Exemplos:
Glicose: C6H12O6 ou C6(H2O)6
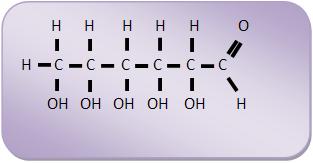
Frutose: C6H12O6
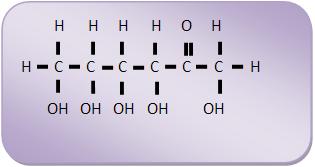
14 – Oses (monossacáridos ou monossacarídeos)Oses ou monossacarídeos são todos os açúcares que não se hidrolisam, como por exemplo, a glicose, a frutose e a galactose de fórmula C6H12O6.
Subdividem-se em:
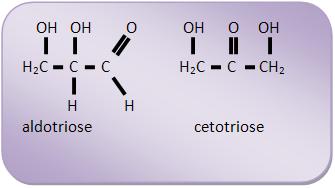
Aldoses: todos que apresentam o grupo aldeídico. Conforme o número de átomos de C classifica-se em aldotriose (3C); aldotetrose (4C) etc.
Cetoses: todos que apresentam o grupo cetônico. Classificam-se também em cetotriose, cetotetrose etc.
16 – Isomeria nos açúcares
Quando uma aldose apresenta n átomos de carbono, ela irá possuir (n - 2) átomos de carbono assimétricos e diferentes, ou seja, 2n-2 isômeros opticamente ativos.
Quando uma Cetose apresenta n átomos de carbono, ela irá possuir (n – 3) átomos de carbono assimétricos e diferentes, ou seja, 2n-3 isômeros opticamente ativos.
É possível uma cetoexose possuir 3 carbonos assimétricos diferentes. Portanto podemos concluir que também é possível oito isômeros, onde destes oito isômeros apenas a frutose será “farta” na natureza.
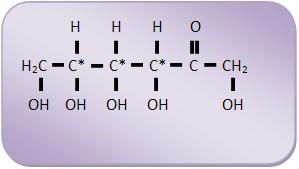
É possível uma aldoexose possuir 4 carbonos assimétricos diferentes. Portanto podemos concluir que também são possíveis 16 isômeros, onde destes 16 isômeros apenas três serão abundantes na natureza: a glicose, a galactose a manose.
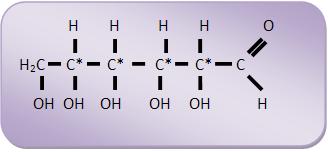
17 – Estrutura dos monossacarídeos
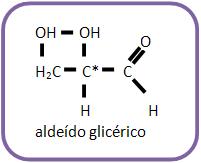 O estudo das estruturas das oses é realizado a partir da aldose mais simples, o aldeído glicérico (aldotriose).
O estudo das estruturas das oses é realizado a partir da aldose mais simples, o aldeído glicérico (aldotriose).
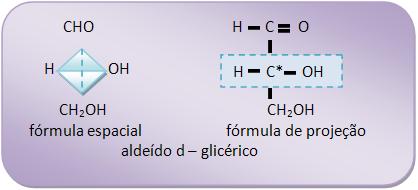
Este aldeído apresenta 1 átomo de C assimétrico, e pode ser representado por dois antípodas ópticos: o dextrogiro (aldeído d – glicérico) e o levogiro (aldeído l – glicérico).
As fórmulas de projeção dos antípodas aldeídos glicéricos, na vertical, são:
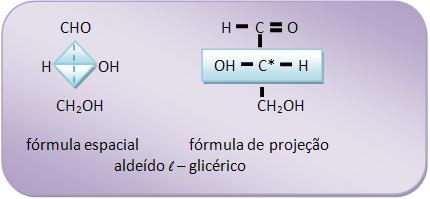
As oses possuem estruturas convencionadas a partir dos aldeídos glicéricos. A cadeia carbônica da oses só aumenta a partir do grupo aldeídico.
Como por exemplo: a partir do aldeído d – glicérico, uma aldotetrose em que a base (os últimos átomos de carbono) da cadeia será igual a da altotriose inicial.
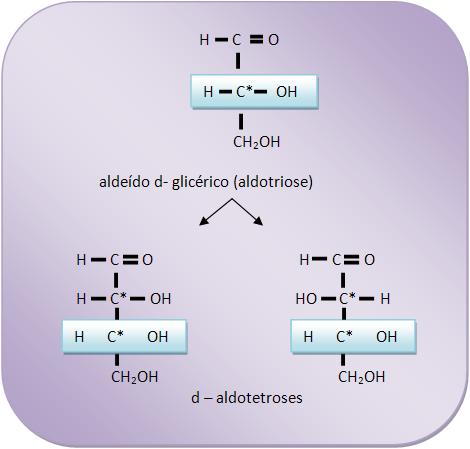
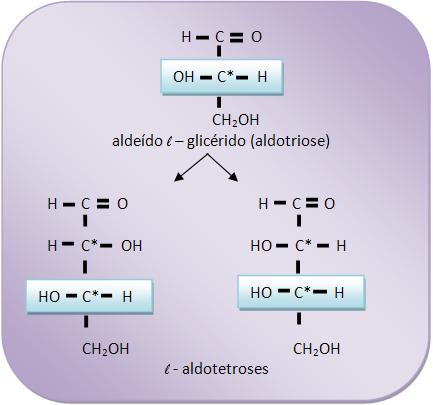
A nomenclatura das duas aldotetroses receberão a letra d, pois são resultantes do aldeído d – glicérico. A mesma regra deve ser seguida com as aldotetroses resultantes do aldeído l
19 – Propriedades físicas dos glicídeos
Como já vimos, as oses são consideradas compostos cristalinos, que são solúveis em água, incolores e não muito solúveis em solventes orgânicos, com saber adocicado. As propriedades dos dissacarídeos possuem propriedades físicas parecidas. Já os polissacarídeos são insolúveis em água, sem sabor e amorfos.
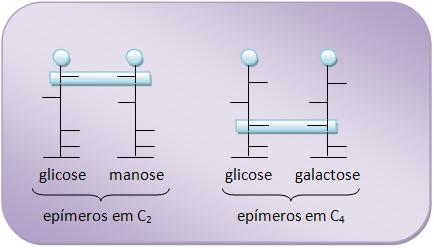
20 – Oses epímeras
São oses que apresentam uma diferença na configuração de um único carbono assimétrico.
Vejamos o exemplo abaixo:
• Glicose e manose são epímeros em C2.
• Glicose e gactose são epímeros em C4.
21 – Propriedades químicas das oses
a) Estrutura de óxido
Em solução, os monossacarídeos fornecem semi – acetais (álcool-éter) internos, havendo a possibilidade de formar semi-acetais pentacíclicos denominado furanoses, ou até mesmo semi-acetais hexacíclicos denominado piranoses.
b) Mutarrotação
É quando o poder rotatório específico de um monossacarídeo varia no decorrer de um intervalo de tempo, quando o açúcar é dissolvido em água.
23 – Frutose
 (levulose)
(levulose)
A frutose também é encontrada no mel, nos frutos doces, mas sempre na forma d (–).
24 – Sacarose
 (açúcar da cana, açúcar comum)
(açúcar da cana, açúcar comum)
a) Ocorrência
A sacarose é muito encontrada em plantas, mas em especial na cana–de–açúcar e na beterraba.
b) Obtenção
Vejamos a seguinte seqüência:
1) Obtenção da garapa.
2) Precipitação das proteínas e ácidos livres através do tratamento com hidróxido de cálcio.
3) Eliminação do excesso de Ca(OH)2, borbulhando CO2 (precipita CaCO3).
4) Filtração e cristalização através da centrifugação, separando o melaço do açúcar.
c) Constituição
A sacarose é o resultado da condensação de α – glicose – piranose com β – frutose – furanose através dos grupos (OH) glicosídicos de cada uma.
d) Propriedades
Dentro das propriedades, a sacarose não diminui o licor de Fehling, pelo fato de não haver um grupo aldeídico potencial ou livre.
É importante sabermos que a sacarose se cristaliza facilmente e não apresenta mutarrotação.
25 – Celulose
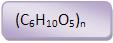
a) Ocorrência:
A celulose é encontrada em todos os vegetais, mas em especial no algodão que possuí 95% de celulose.
b) Constituição:
A celulose é resultado da condensação de moléculas de β–glicose.
A celulose possui uma massa molecular média da ordem de 400.000u, o que faz com que se torne indigerível pelo organismo humano.
c) Aplicação:
1) Fabricação do papel, tecidos de algodão.
2) Preparação do algodão – pólvora (pólvora sem fumaça), explosivo potente. É o tinitrato de celulose, obtido pela esterificação das 3 oxidrilas para cada 6 átomos de carbono com mistura sulfonítrica.
3) Preparação das piroxilinas (mono e dinitrato de celulose), utilização na fabricação de celulóide, filmes, linhos, sedas artificiais.
4) Fabricação de vidros de segurança para carros.
26 - Amido

a) Ocorrência
O amido está presente na substância de reserva dos vegetais.
b) Constituição
O amido é resultado da condensação de moléculas de α – glicose.
c) Aplicações
1) Alimentação
2) Fabricação de cola, da glicose (hidrólise) e álcool etílico.
3) Na iodometria, a solução de amido aparece como indicador. Adquire com o iodo uma coloração violeta, que desaparece com sofre aquecimento, mas a coloração volta quando houver resfriamento.
O glicogênio é o amido animal, formado no fígado, pela condensação de moléculas de glicose, queimando as exigências metabólicas.
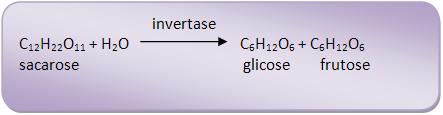
28 – Fermentação alcoólica a partir do melaçoAo extrair a sacarose da cana-de-açúcar, obtém-se um líquido que recebe o nome de melaço, que possui de 30 a 40% de açúcar. O melaço na presença do levedo Saccharomyces cerevisiar, “produz” uma enzima denominada invertase, que catalisa a hidrólise da sacarose:
Vejamos:
A sacarose, na presença de ácidos minerais sofre hidrólise. A hidrólise da sacarose é denominada inversão da sacarose.
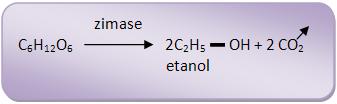
O Sacchamoryces cerevisiae forma outra enzima, que catalisa a transformação dos dois isômeros em álcool etílico e é conhecida como zimaze.
A sacarose é dextrogira e a resultante de glicose e a frutose são levogira.
A destilação do líquido é o resultado da fermentação, denominado mosto ou vinho, obtendo assim o álcool bruto com em média de 90% de álcool e também um resíduo que recebe o nome de vinhaça, que serve de alimento para o gado.
O álcool bruto é sujeito à uma nova destilação formando as seguintes frações:
Vejamos:
1) Produto de cabeça: formado pelo aldeído acético, acetais etc.
2) Produto de coração: 96% de álcool e 4% de água.
3) Produto de cauda ou óleo de fúsel: álcoois amílicos, álcoois propílicos, etc.
29 – Fermentação acética
A fermentação acética consiste na reação de transformação do vinho em vinagre, que é catalisada através da enzima alcooxidase, formada pelo fungo Micoderma aceti.

Na fermentação acética originam-se também outros compostos que vão dando sabor e cheiro característico para o vinagre.
30 – BiomassaAs árvores, arbustos, resíduos florestais, plantas aquáticas, dejetos animais, entre outros, formam uma matéria orgânica denominada biomassa.
Para que se tenha energia utilizável, deve haver o envolvimento de vários processos químicos e biológicos. Vejamos um desses processos:
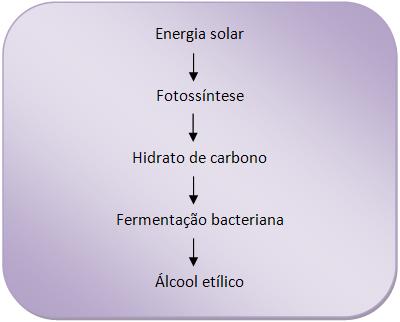
O processo acima também é abordado na fermentação alcoólica.
31 – AminoácidosOs aminoácidos são todos os compostos que possuem uma função mista amina (– NH2) e ácido carboxílico (– COOH).
34 – Propriedades químicas dos aminoácidosO grupo carboxila ( - COOH) e o grupo amino ( - NH2), estão presentes na estrutura dos aminoácidos, por este motivos aminoácidos possuem um caráter anfótero e também uma importante propriedade de passar por uma polimerização formando proteínas.
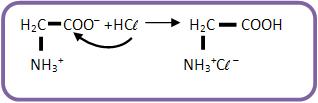
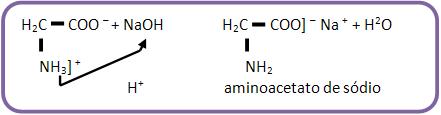
35 – Caráter anfóteroPor apresentarem um grupo ácido e outro básico, os aminoácidos reagem tanto com as bases minerais como com os ácidos minerais. Eles se apresentam na forma de sais, pelo fato de haver uma neutralização intramolecular, este fato explica o estado sólido dos aminoácidos e a solubilidade em água.
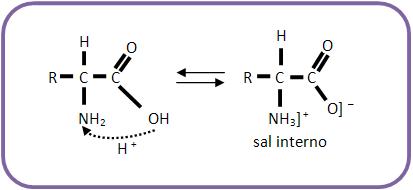
O resultado é um íon dipolar que apresenta um momento dipolar elevado, denominado zwitterion.
Reação com ácido:
Reação com base:
37 – A ligação peptídica
A ligação das moléculas de α–aminoácidos que se condensam, recebem o nome de ligação peptídica, que formam compostos denominados polipeptídeos.
A condensação de milhares de moléculas de aminoácidos é o resultado das proteínas.
Os produtos de massa molecular até 10.000u são denominados por convenção peptídeos, e os de massa molecular superior são denominados proteínas.
38 – Estrutura primária das proteínas
Uma proteína por convenção é considerada um polipeptídeo que contêm massa molecular acima de 10.000u. Uma proteína é considerada uma poliamida, contendo resíduos de aminoácidos, que ficam ligados uns aos outros através da ligação amida.
O grupo amida:

A sequência dos resíduos de aminoácidos na cadeia peptídica é chamada de estrutura primária.
Com os aminoácidos glicina e alanina são possíveis dois dipeptídeos diferentes.
39 – Estrutura secundária das proteínas
A forma que as cadeias peptídicas se “espalham” no espaço, é denominada estrutura secundária. Essas cadeias podem formar hélice e folhas, o que recebe o nome de cadeias enoveladas. Essas formas são “sustentadas” pelas pontes de hidrogênio que ligam as cadeias partes da mesma cadeia ou cadeias diferentes.
40 – Desnaturação de uma proteínaEssa desnaturação consiste em uma precipitação irreversível da proteína, que ocorre por causa do calor, alguns agentes, base ou ácido. As modificações na estrutura secundária são chamadas de desnaturação.
A ovalbumina é um exemplo de desnaturação que ocorre por causa do calor na coagulação da clara do ovo.
41 – Hidrólise das proteínas
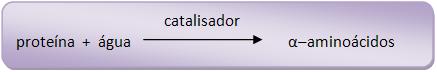
A hidrólise das proteínas ocorre no processo de aquecimento prolongado de uma proteína na presença de ácido forte ou base forte diluídos formando assim α–aminoácidos. A hidrólise catalítica ocorre no organismo humano, ocorrendo pela ação das enzimas como pepsina o suco gástrico e erepsina suco pancreático.
42 – Enzimas
As enzimas são proteínas que apresentam facilidade de catalisar reações químicas. Na nomenclatura usa-se o sufixo “ase” para denominar uma enzima, como por exemplo: peptidase.
43 – Proteínas conjugadasAs proteínas conjugadas são compostas porções peptídica, denominada grupos prostéticos, relacionado com a ação biológica da proteína, como por exemplo, o grupo prostético da hemoglobina que é o heme.
44 – Classificação das proteínas
Existem duas classificações para as proteínas, vejamos cada uma delas:
As proteínas fibrosas são compostas de moléculas longas e filamentosas dispostas, que ficam lado a lado para formar as fibras e são insolúveis em água. Elas constituem a estrutura dos tecidos animais. Exemplo: na unha, no cabelo, na lã e etc.
As proteínas globulares são formadas por moléculas dobradas com uma forma esferoidal e são solúveis em água. Pelo fato delas serem solúveis em água é que as moléculas se dobram. Exemplo: hemoglobina, enzimas, anticorpos e etc
http://www.colegioweb.com.br/quimica
Os cérides são considerados misturas de alcoóis superiores, ou seja, de cadeia carbônica grande com ésteres de ácidos graxos.
12 – Hidratos de carbono (carboidratos, açúcares, glúcides, glicídios)
Os hidratos de carbono são considerados compostos de função mista poliálcool-aldeído ou poliálcool-cetona, formando os referidos compostos de função mista.
Fórmula geral:
Exemplos:
Glicose: C6H12O6 ou C6(H2O)6

Frutose: C6H12O6

13 – Classificação dos carboidratos
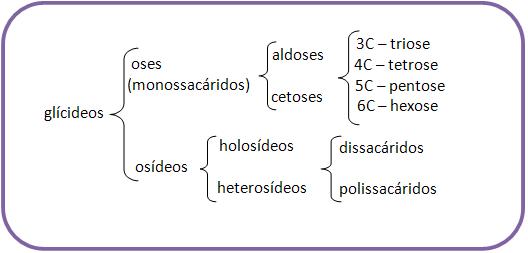

14 – Oses (monossacáridos ou monossacarídeos)Oses ou monossacarídeos são todos os açúcares que não se hidrolisam, como por exemplo, a glicose, a frutose e a galactose de fórmula C6H12O6.
Subdividem-se em:
Aldoses: todos que apresentam o grupo aldeídico. Conforme o número de átomos de C classifica-se em aldotriose (3C); aldotetrose (4C) etc.
Cetoses: todos que apresentam o grupo cetônico. Classificam-se também em cetotriose, cetotetrose etc.

15 – Osídeos
Os osídeos são dos os açúcares que se hidrolisam formando oses.
Eles se classificam em:
1) Holosídeos:
Holosídeos são osídeos, que através da hidrólise fornecem oses.
Eles se subdividem em:
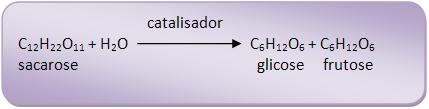
Dissacáridos (dissacarídeos):
Dissacáridos (dissacarídeos) são os açúcares que se hidrolisam, fornecendo duas moléculas de monossacáridos.
Vejamos o exemplo:
Sacarose, maltose, de fórmula C12H22O11
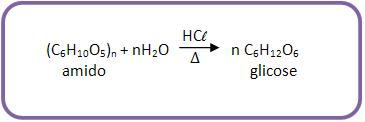
Polissacáridos:
Polissacáridos são os açúcares que se hidrolisam, originando mais de duas moléculas de monossacáridos.
Vejamos o exemplo:
Amido, celulose, de fórmula (C6H10O5)n.
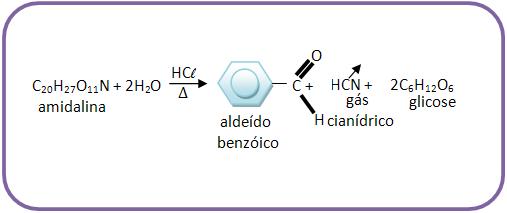
2) Heterosídeos:
Heterosídeos são osídeos, que através da hidrólise fornece tanto as oses como outros compostos.
Vejamos o exemplo:
Amidalina (semente de amêndoas amargas)
Os osídeos são dos os açúcares que se hidrolisam formando oses.
Eles se classificam em:
1) Holosídeos:
Holosídeos são osídeos, que através da hidrólise fornecem oses.
Eles se subdividem em:
Dissacáridos (dissacarídeos):
Dissacáridos (dissacarídeos) são os açúcares que se hidrolisam, fornecendo duas moléculas de monossacáridos.
Vejamos o exemplo:
Sacarose, maltose, de fórmula C12H22O11

Polissacáridos:
Polissacáridos são os açúcares que se hidrolisam, originando mais de duas moléculas de monossacáridos.
Vejamos o exemplo:
Amido, celulose, de fórmula (C6H10O5)n.

2) Heterosídeos:
Heterosídeos são osídeos, que através da hidrólise fornece tanto as oses como outros compostos.
Vejamos o exemplo:
Amidalina (semente de amêndoas amargas)

16 – Isomeria nos açúcares
Quando uma aldose apresenta n átomos de carbono, ela irá possuir (n - 2) átomos de carbono assimétricos e diferentes, ou seja, 2n-2 isômeros opticamente ativos.
Quando uma Cetose apresenta n átomos de carbono, ela irá possuir (n – 3) átomos de carbono assimétricos e diferentes, ou seja, 2n-3 isômeros opticamente ativos.
É possível uma cetoexose possuir 3 carbonos assimétricos diferentes. Portanto podemos concluir que também é possível oito isômeros, onde destes oito isômeros apenas a frutose será “farta” na natureza.

É possível uma aldoexose possuir 4 carbonos assimétricos diferentes. Portanto podemos concluir que também são possíveis 16 isômeros, onde destes 16 isômeros apenas três serão abundantes na natureza: a glicose, a galactose a manose.

17 – Estrutura dos monossacarídeos
 O estudo das estruturas das oses é realizado a partir da aldose mais simples, o aldeído glicérico (aldotriose).
O estudo das estruturas das oses é realizado a partir da aldose mais simples, o aldeído glicérico (aldotriose).Este aldeído apresenta 1 átomo de C assimétrico, e pode ser representado por dois antípodas ópticos: o dextrogiro (aldeído d – glicérico) e o levogiro (aldeído l – glicérico).
As fórmulas de projeção dos antípodas aldeídos glicéricos, na vertical, são:


As oses possuem estruturas convencionadas a partir dos aldeídos glicéricos. A cadeia carbônica da oses só aumenta a partir do grupo aldeídico.
Como por exemplo: a partir do aldeído d – glicérico, uma aldotetrose em que a base (os últimos átomos de carbono) da cadeia será igual a da altotriose inicial.

A nomenclatura das duas aldotetroses receberão a letra d, pois são resultantes do aldeído d – glicérico. A mesma regra deve ser seguida com as aldotetroses resultantes do aldeído l

18 – Simplificação das fórmulas estruturais das oses
Normalmente representa-se as fórmulas das aldoses e cetoses na vertical. Na fórmula, uma bola pode representar o grupo aldeído, o sinal = O representa o grupo cetona, um traço o grupo hidroxila e uma linha vertical a cadeia principal.
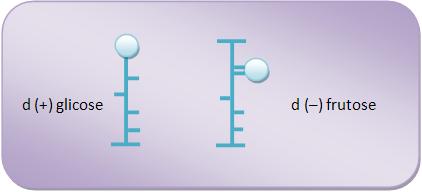
Normalmente representa-se as fórmulas das aldoses e cetoses na vertical. Na fórmula, uma bola pode representar o grupo aldeído, o sinal = O representa o grupo cetona, um traço o grupo hidroxila e uma linha vertical a cadeia principal.

19 – Propriedades físicas dos glicídeos
Como já vimos, as oses são consideradas compostos cristalinos, que são solúveis em água, incolores e não muito solúveis em solventes orgânicos, com saber adocicado. As propriedades dos dissacarídeos possuem propriedades físicas parecidas. Já os polissacarídeos são insolúveis em água, sem sabor e amorfos.
20 – Oses epímeras
São oses que apresentam uma diferença na configuração de um único carbono assimétrico.
Vejamos o exemplo abaixo:
• Glicose e manose são epímeros em C2.
• Glicose e gactose são epímeros em C4.

21 – Propriedades químicas das oses
a) Estrutura de óxido
Em solução, os monossacarídeos fornecem semi – acetais (álcool-éter) internos, havendo a possibilidade de formar semi-acetais pentacíclicos denominado furanoses, ou até mesmo semi-acetais hexacíclicos denominado piranoses.
b) Mutarrotação
É quando o poder rotatório específico de um monossacarídeo varia no decorrer de um intervalo de tempo, quando o açúcar é dissolvido em água.
22 – Glicose
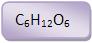
(glucose, dextrose, açúcar de uva)
a) Ocorrência
A glicose é encontrada no mel e frutos doces (principalmente uva).
b) Obtenção
Hidrólise do amido em meio ácido:
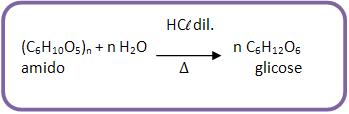
c) Aplicações
1) Fabricação de álcool etílico.
2) Alimentação de crianças, de atletas (após as competições).
(glucose, dextrose, açúcar de uva)
a) Ocorrência
A glicose é encontrada no mel e frutos doces (principalmente uva).
b) Obtenção
Hidrólise do amido em meio ácido:

c) Aplicações
1) Fabricação de álcool etílico.
2) Alimentação de crianças, de atletas (após as competições).
23 – Frutose
A frutose também é encontrada no mel, nos frutos doces, mas sempre na forma d (–).
24 – Sacarose
a) Ocorrência
A sacarose é muito encontrada em plantas, mas em especial na cana–de–açúcar e na beterraba.
b) Obtenção
Vejamos a seguinte seqüência:
1) Obtenção da garapa.
2) Precipitação das proteínas e ácidos livres através do tratamento com hidróxido de cálcio.
3) Eliminação do excesso de Ca(OH)2, borbulhando CO2 (precipita CaCO3).
4) Filtração e cristalização através da centrifugação, separando o melaço do açúcar.
c) Constituição
A sacarose é o resultado da condensação de α – glicose – piranose com β – frutose – furanose através dos grupos (OH) glicosídicos de cada uma.
d) Propriedades
Dentro das propriedades, a sacarose não diminui o licor de Fehling, pelo fato de não haver um grupo aldeídico potencial ou livre.
É importante sabermos que a sacarose se cristaliza facilmente e não apresenta mutarrotação.
25 – Celulose
a) Ocorrência:
A celulose é encontrada em todos os vegetais, mas em especial no algodão que possuí 95% de celulose.
b) Constituição:
A celulose é resultado da condensação de moléculas de β–glicose.
A celulose possui uma massa molecular média da ordem de 400.000u, o que faz com que se torne indigerível pelo organismo humano.
c) Aplicação:
1) Fabricação do papel, tecidos de algodão.
2) Preparação do algodão – pólvora (pólvora sem fumaça), explosivo potente. É o tinitrato de celulose, obtido pela esterificação das 3 oxidrilas para cada 6 átomos de carbono com mistura sulfonítrica.
3) Preparação das piroxilinas (mono e dinitrato de celulose), utilização na fabricação de celulóide, filmes, linhos, sedas artificiais.
4) Fabricação de vidros de segurança para carros.
26 - Amido
a) Ocorrência
O amido está presente na substância de reserva dos vegetais.
b) Constituição
O amido é resultado da condensação de moléculas de α – glicose.
c) Aplicações
1) Alimentação
2) Fabricação de cola, da glicose (hidrólise) e álcool etílico.
3) Na iodometria, a solução de amido aparece como indicador. Adquire com o iodo uma coloração violeta, que desaparece com sofre aquecimento, mas a coloração volta quando houver resfriamento.
O glicogênio é o amido animal, formado no fígado, pela condensação de moléculas de glicose, queimando as exigências metabólicas.
27 – Fermentação
A fermentação consiste na reação que ocorre entre dois compostos orgânicos, onde essa reação é catalisada por enzimas ou fermentos, que são elaborados por microorganismos.
Os microorganismos na fermentação alcoólica são chamados de levedos.
O melaço de cana-de-açúcar, os cereais, a madeira e o suco de beterraba são substâncias postas como matéria-prima durante a fabricação de álcool etílico, através do processo de fermentação.
A fermentação consiste na reação que ocorre entre dois compostos orgânicos, onde essa reação é catalisada por enzimas ou fermentos, que são elaborados por microorganismos.
Os microorganismos na fermentação alcoólica são chamados de levedos.
O melaço de cana-de-açúcar, os cereais, a madeira e o suco de beterraba são substâncias postas como matéria-prima durante a fabricação de álcool etílico, através do processo de fermentação.
28 – Fermentação alcoólica a partir do melaçoAo extrair a sacarose da cana-de-açúcar, obtém-se um líquido que recebe o nome de melaço, que possui de 30 a 40% de açúcar. O melaço na presença do levedo Saccharomyces cerevisiar, “produz” uma enzima denominada invertase, que catalisa a hidrólise da sacarose:
Vejamos:

A sacarose, na presença de ácidos minerais sofre hidrólise. A hidrólise da sacarose é denominada inversão da sacarose.
O Sacchamoryces cerevisiae forma outra enzima, que catalisa a transformação dos dois isômeros em álcool etílico e é conhecida como zimaze.

A sacarose é dextrogira e a resultante de glicose e a frutose são levogira.
A destilação do líquido é o resultado da fermentação, denominado mosto ou vinho, obtendo assim o álcool bruto com em média de 90% de álcool e também um resíduo que recebe o nome de vinhaça, que serve de alimento para o gado.
O álcool bruto é sujeito à uma nova destilação formando as seguintes frações:
Vejamos:
1) Produto de cabeça: formado pelo aldeído acético, acetais etc.
2) Produto de coração: 96% de álcool e 4% de água.
3) Produto de cauda ou óleo de fúsel: álcoois amílicos, álcoois propílicos, etc.
29 – Fermentação acética
A fermentação acética consiste na reação de transformação do vinho em vinagre, que é catalisada através da enzima alcooxidase, formada pelo fungo Micoderma aceti.

Na fermentação acética originam-se também outros compostos que vão dando sabor e cheiro característico para o vinagre.
30 – BiomassaAs árvores, arbustos, resíduos florestais, plantas aquáticas, dejetos animais, entre outros, formam uma matéria orgânica denominada biomassa.
Para que se tenha energia utilizável, deve haver o envolvimento de vários processos químicos e biológicos. Vejamos um desses processos:

O processo acima também é abordado na fermentação alcoólica.
31 – AminoácidosOs aminoácidos são todos os compostos que possuem uma função mista amina (– NH2) e ácido carboxílico (– COOH).
32 – Classificação e nomenclatura dos aminoácidos
A classificação e a nomenclatura dos aminoácidos variam conforme a posição do grupo amino, como por exemplo: α, β, γ etc.
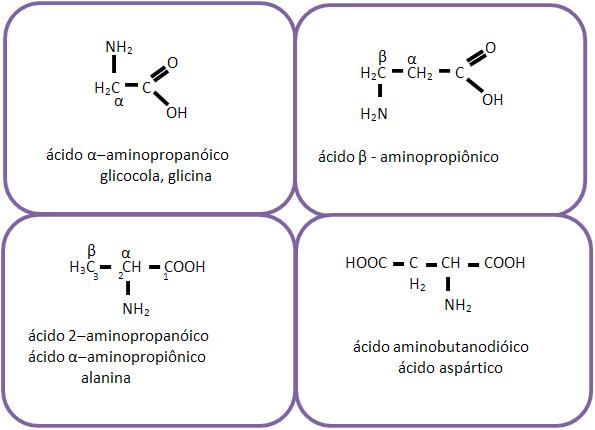
A classificação e a nomenclatura dos aminoácidos variam conforme a posição do grupo amino, como por exemplo: α, β, γ etc.

33 – Ocorrência dos aminoácidos
A proteína possui vinte e três componentes, sendo α–aminoácidos que se tornam os aminoácidos mais importantes.
Existem aminoácidos que não sintetizam com o metabolismo humano, aparecem na dieta, mas em forma de proteínas, denominados aminoácidos essenciais, como por exemplo: arginina, fenilalanina, histidina, isoleucina, leucina, lisina, metionina tripfana tronina e vanila.
Já os aminoácidos não-essenciais são sintetizados pelo organismo humano.
A proteína possui vinte e três componentes, sendo α–aminoácidos que se tornam os aminoácidos mais importantes.
Existem aminoácidos que não sintetizam com o metabolismo humano, aparecem na dieta, mas em forma de proteínas, denominados aminoácidos essenciais, como por exemplo: arginina, fenilalanina, histidina, isoleucina, leucina, lisina, metionina tripfana tronina e vanila.
Já os aminoácidos não-essenciais são sintetizados pelo organismo humano.
34 – Propriedades químicas dos aminoácidosO grupo carboxila ( - COOH) e o grupo amino ( - NH2), estão presentes na estrutura dos aminoácidos, por este motivos aminoácidos possuem um caráter anfótero e também uma importante propriedade de passar por uma polimerização formando proteínas.
35 – Caráter anfóteroPor apresentarem um grupo ácido e outro básico, os aminoácidos reagem tanto com as bases minerais como com os ácidos minerais. Eles se apresentam na forma de sais, pelo fato de haver uma neutralização intramolecular, este fato explica o estado sólido dos aminoácidos e a solubilidade em água.

O resultado é um íon dipolar que apresenta um momento dipolar elevado, denominado zwitterion.
Reação com ácido:

Reação com base:

37 – A ligação peptídica
A ligação das moléculas de α–aminoácidos que se condensam, recebem o nome de ligação peptídica, que formam compostos denominados polipeptídeos.
A condensação de milhares de moléculas de aminoácidos é o resultado das proteínas.
Os produtos de massa molecular até 10.000u são denominados por convenção peptídeos, e os de massa molecular superior são denominados proteínas.
38 – Estrutura primária das proteínas
Uma proteína por convenção é considerada um polipeptídeo que contêm massa molecular acima de 10.000u. Uma proteína é considerada uma poliamida, contendo resíduos de aminoácidos, que ficam ligados uns aos outros através da ligação amida.
O grupo amida:

A sequência dos resíduos de aminoácidos na cadeia peptídica é chamada de estrutura primária.
Com os aminoácidos glicina e alanina são possíveis dois dipeptídeos diferentes.
39 – Estrutura secundária das proteínas
A forma que as cadeias peptídicas se “espalham” no espaço, é denominada estrutura secundária. Essas cadeias podem formar hélice e folhas, o que recebe o nome de cadeias enoveladas. Essas formas são “sustentadas” pelas pontes de hidrogênio que ligam as cadeias partes da mesma cadeia ou cadeias diferentes.
40 – Desnaturação de uma proteínaEssa desnaturação consiste em uma precipitação irreversível da proteína, que ocorre por causa do calor, alguns agentes, base ou ácido. As modificações na estrutura secundária são chamadas de desnaturação.
A ovalbumina é um exemplo de desnaturação que ocorre por causa do calor na coagulação da clara do ovo.
41 – Hidrólise das proteínas
A hidrólise das proteínas ocorre no processo de aquecimento prolongado de uma proteína na presença de ácido forte ou base forte diluídos formando assim α–aminoácidos. A hidrólise catalítica ocorre no organismo humano, ocorrendo pela ação das enzimas como pepsina o suco gástrico e erepsina suco pancreático.

42 – Enzimas
As enzimas são proteínas que apresentam facilidade de catalisar reações químicas. Na nomenclatura usa-se o sufixo “ase” para denominar uma enzima, como por exemplo: peptidase.
43 – Proteínas conjugadasAs proteínas conjugadas são compostas porções peptídica, denominada grupos prostéticos, relacionado com a ação biológica da proteína, como por exemplo, o grupo prostético da hemoglobina que é o heme.
44 – Classificação das proteínas
Existem duas classificações para as proteínas, vejamos cada uma delas:
As proteínas fibrosas são compostas de moléculas longas e filamentosas dispostas, que ficam lado a lado para formar as fibras e são insolúveis em água. Elas constituem a estrutura dos tecidos animais. Exemplo: na unha, no cabelo, na lã e etc.
As proteínas globulares são formadas por moléculas dobradas com uma forma esferoidal e são solúveis em água. Pelo fato delas serem solúveis em água é que as moléculas se dobram. Exemplo: hemoglobina, enzimas, anticorpos e etc
http://www.colegioweb.com.br/quimica

Adorei. Continuem postando artigos interessantes.
ResponderExcluir